
T℃时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g) + CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO) = 0.080 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.11 mol·L-1,则反应的ΔH < 0
C.T℃时起始向容器中充入0.9 mol COCl2、0.20 mol Cl2和0.20 mol CO,达平衡前v正 > v逆
D.恒温恒容下,平衡后向体系内加入少量惰性气体,氯气的浓度不变
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:实验题
(7分)污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物。某小组同学拟探究H2C2O4浓度对反应速率的影响。
实验仪器
I.实验原理
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
II.实验设计
(1)【方案一】测量气体产物:在相同温度下,利用下图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响)。下图方框中应选择 (填编号)仪器组装量气装置,限选以下仪器:
①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒、⑦秒表。

(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间。拟定实验数据:
实验序号 | 温度/℃ | 各物质的体积 / mL | 反应时间 | |||
H2O | 3 mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6 mol/LH2C2O4溶液 | |||
1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
表中①、②处的数据分别是 、 。
III.讨论与交流
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如下图所示。他们认为:0~t时间内,速率变快的可能原因是 。

(4)实验室常用KMnO4标准溶液滴定某浓度草酸。KMnO4溶液置于 (填仪器名称)中,判断到达滴定终点的现象是 。若滴开始时,滴定管中有气泡,滴定结束时气泡消失,则测定结果 (填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
当光束通过下列物质时,能观察到丁达尔效应的是
①有尘埃的空气 ②酒精 ③墨水 ④稀豆浆 ⑤硫酸铜溶液
A.①②④ B.①③⑤ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
将下图所示实验装置的 K 闭合,下列判断正确的是
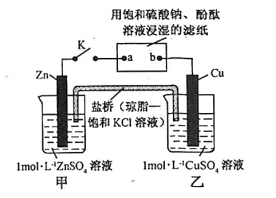
A.Cu 电极上发生氧化反应
B.电子沿 Cu→b→a→Zn路径流动
C.片刻后乙池中c(SO42-)增大
D.片刻后可观察到滤纸a点变红色
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是
A.升高温度
B.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl
C.用1 mol/L的H2SO4代替1 mol/L的HCl
D.用锌粉代替锌粒
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:选择题
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
A.1∶1 B.2∶1 C.1∶10 D.10∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:选择题
某学生的实验报告所列出的下列数据中合理的是
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25 mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期期中考试化学试卷(解析版) 题型:选择题
运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省新密市高三第三次月考化学试卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
ⅰCH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
ⅱCO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
②利用反应ⅱ,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
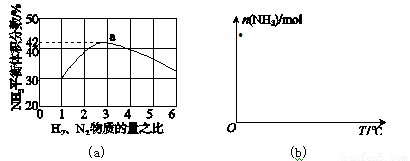
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com