
| A. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 | |
| B. | SO2是大气污染物,可以用生石灰除去工业废气中的SO2 | |
| C. | 明矾水解产生Al(OH)3胶体粒子,可除去悬浮物 | |
| D. | 使用清洁能源是防止酸雨发生的重要措施之一 |
分析 A.含磷洗衣粉的使用只是造成水体富营养化的原因之一;
B.生石灰能与二氧化硫、氧气反应生成硫酸钙;
C.明矾中的铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用;
D.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化硫、氮氧化物的排放.
解答 解:A.含磷洗衣粉的使用只是造成水体富营养化的原因之一,因此使用无磷洗衣粉,不可能彻底解决水体富营养化问题,故A错误;
B.生石灰能与二氧化硫、氧气反应生成硫酸钙,可除去,故B正确;
C.明矾中的铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用;可用于水的净化,故C正确;
D.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体形成的,使用清洁能源减少了二氧化硫、氮氧化物的排放,所以使用清洁能源是防止酸雨发生的重要措施之一,故D正确.
故选A.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
 如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )
如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )| A. | t1时,正方向速率大于逆反应速率 | |
| B. | t2时,反应体系中NH3的浓度达到最大值 | |
| C. | t2-t3时间段,正反应速率等于逆反应速率 | |
| D. | t2-t3时间段,各物质的浓度相等且不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
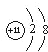 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
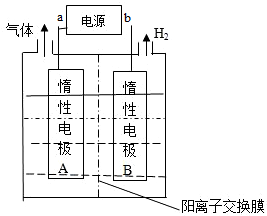
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
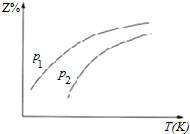
| A. | △H<0 | |
| B. | 若p1>p2,则Y一定呈气态 | |
| C. | 升高温度,该反应的化学平衡常数减小 | |
| D. | 反应处于平衡状态时,有c(X):c(2)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
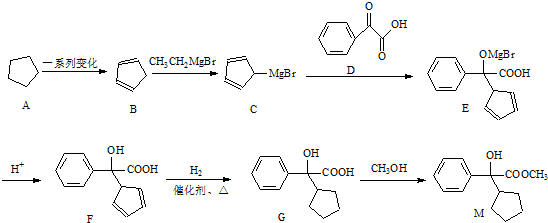
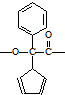
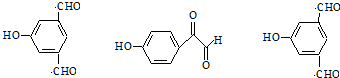
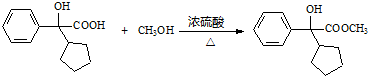 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com