
分析 (1)书写电解质电离方程式应分清电解质强弱,强电解质完全电离,用等号,弱电解质部分电离应等号;
(2)①硫酸铜溶液和氢氧化钠溶液混合反应生成氢氧化铜和硫酸钠;
②碳酸钠溶液与过量的稀盐酸混合反应生成氯化钠、水和二氧化碳;
解答 解:(1)①Ba(OH)2:为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
②Al2(SO4)3 为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
③H2SO4 为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-;
故答案为:①Ba(OH)2=Ba2++2OH-;②Al2(SO4)3=2Al3++3SO42-;③H2SO4=2H++SO42-
(2)①硫酸铜溶液和氢氧化钠溶液混合反应生成氢氧化铜和硫酸钠,离子 方程式:Cu2++2OH-=Cu(OH)2↓
;
②碳酸钠溶液与过量的稀盐酸混合反应生成氯化钠、水和二氧化碳,离子方程式:2H++CO32-=H2O+CO2↑;
故答案为:①Cu2++2OH-=Cu(OH)2↓;
②2H++CO32-=H2O+CO2↑
点评 本题考查了离子方程式的书写,侧重考查电解质电离方程式书写,明确电解质强弱及电离方式、明确物质发生反应实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: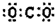 | |
| B. | 基态Fe原子的外围电子排布图为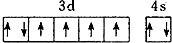 | |
| C. | 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
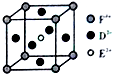 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):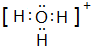 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀 HNO3反应制备 H2 | B. | 加热分解 NH4Cl 固体制 NH3 | ||
| C. | 大理石与稀 H2SO4反应制备 CO2 | D. | 亚硫酸钠与浓 H2SO4反应制备 SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com