
| A. | 原子半径X>Y>Z | |
| B. | 离子半径Ym->Xn+>Zm+ | |
| C. | 三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X,Z,Y | |
| D. | Y在自然界中没有游离态,可形成原子晶体 |
分析 Xn+比Zm+多一个电子层,三种原子的M层电子数均为偶数,可知Z为第三周期金属元素,Z与Y同周期,Y为第三周期的非金属元素,而X为第四周期的K或Ca,以此来解答.
解答 解:由上述分析可知,m>n,若X为K,Z为Mg,Y为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径X>Z>Y,故A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径Ym->Xn+>Zm+,故B正确;
C.金属性越强,对应最高价氧化物对应水化物碱性越强,非金属性越强对应最高价氧化物对应水化物酸性越强,则三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X、Z、Y,故C正确;
D.Y为S,在自然界中没有游离态,以共价键形成化合物,但不能形成原子晶体,故D错误;
故选AD.
点评 本题考查原子结构和周期律,为高频考点,把握M层电子数为偶数、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量Cl2充分反应,转移电子数为0.2×6.02×1023 | |
| B. | 由PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O可确定氧化性:PbO2>Cl2 | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 常温下,用蒸馏水不断稀释0.1 mol•L-1醋酸,溶液中c(H+)/c(CH3COOH)的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3溶液 | B. | MgC12溶液 | C. | BaC12溶液 | D. | FeC13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制取乙酸乙酯,提高其效率 | 加热,将乙酸乙酯蒸出 |
| B | 比较Mg、Al的金属性 | 分别将打磨过的镁带、铝片放入沸水中 |
| C | 羟基影响与其相连的苯环活性 | 分别将饱和溴水滴入苯和苯酚溶液中 |
| D | 制备Fe2O3固体 | 将H2O(g)通入装有铁粉的试管,加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,1molCH4和2molCH4的燃烧热不同,后者是前者的2倍 | |
| B. | 对于一个确定的反应,反应热的大小与反应路径有关 | |
| C. | 对于反应CaCO3(s)═CaO(s)+CO2(g)△H=+178.2kJ/mol,在高温下才能发生分解,说明能量变化是物质变化的基础 | |
| D. | 化学平衡常数(K)的大小反映了化学反应进行的程度,K值越大,反应物的转化率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
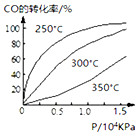 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、I-、SO42- | |
| B. | 使酚酞变红色的溶液:Na+、Al3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液:K+、Na+、NO3-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13 mol•L-1的溶液:Mg2+、Ca2+、NO3-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com