


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、将4mol Cl2通入到含有4mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ |
| B、已知亚硫酸(H2SO3)的第二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:AlO2-+SO2+2 H2O=Al(OH)3↓+HSO3- |
| C、稀氨水溶液吸收了少量二氧化碳气体:NH3?H2O+CO2=NH4++HCO3- |
| D、在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
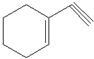 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com