
| A������ʽ��x=2 |
| B����ƽ���������ѹǿ�Ƿ�Ӧ��ʼʱ��2�� |
| C�����������ٳ���3.0 mol M��2.5 mol N������ƽ��ʱQ�����������С |
| D�������ڻ��������ܶȲ��ٱ仯��ƽ����Է����������ٱ仯������Ϊ�ﵽƽ��״̬�ı�־ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
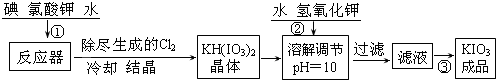
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| W | �����ǵ���ɫ���� | ||
| X | �ڵؿ��еĺ����ӵڶ�λ | ||
| Y | ԭ�������������ǵ���������
| ||
| Z | ��������ԭ�Ӱ뾶��С�Ľ��� |
| A����̬�⻯������ȶ��ԣ�X��W |
| B������������Ӧˮ��������ԣ�Y��X |
| C�����Ӱ뾶��Z��W |
| D��Y���������к��зǼ��Թ��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
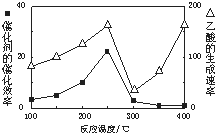 CH4��CO2��Ӧ���������ֵ���ߵĻ�ѧ��Ʒ��
CH4��CO2��Ӧ���������ֵ���ߵĻ�ѧ��Ʒ��| �� �� | CH4 | CO2 | CO | H2 |
| ƽ��Ũ�ȣ�mol?L-1�� | 0.5 | 0.5 | 2.0 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �������� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
| ��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 |
| ������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | A | B | C | D |
| ���� | Ũ���� | �ƾ� | С�մ� | ����� |
| ��ʶ |  |  |  |  |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A���÷�Ӧ���ʱ�Ϊ��ֵ | ||||
| B�����º����£�����ѹǿ��H2Ũ��һ����С�������� | ||||
| C�������¶ȣ��淴Ӧ���ʼ�С | ||||
D���÷�Ӧ�Ļ�ѧ����ʽΪCO+H2O
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 | B��2 | C��13 | D��14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com