
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
分析 A.电荷守恒;
B.澄清石灰水中氢氧化钙需要拆成离子形式;
C.二氧化碳过量反应生成碳酸氢钠;
D.电荷不守恒.
解答 解:A.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.碳酸钠溶液中加入澄清石灰水,离子方程式:Ca2++CO32-=CaCO3↓,故B错误;
C.氢氧化钠溶液中通入过量CO2,离子方程式:OH-+CO2=HCO3-,故C正确;
D.FeCl3溶液与Cu反应,离子方程式:Cu+2Fe3+=Cu2++2Fe2+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确离子反应实质及书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
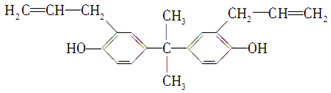
| A. | 该化合物属于芳香烃 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 双酚A不能使溴水褪色,但能使酸性高锰酸钾溶液褪色 | |
| D. | 1 mol双酚A最多可与2 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
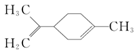 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 分子式为C10H14 | |
| B. | 一定条件下,柠檬烯可以发生加成、取代、氧化、还原反应 | |
| C. | 柠檬烯有属于苯的同系物的同分异构体 | |
| D. | 柠檬烯的分子中所有碳原子可能处在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
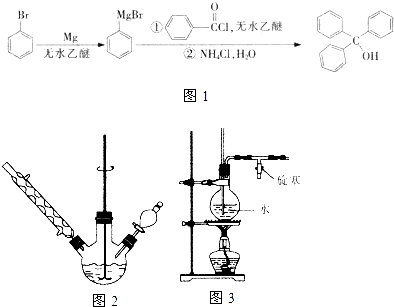 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
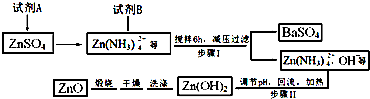
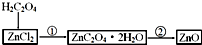
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
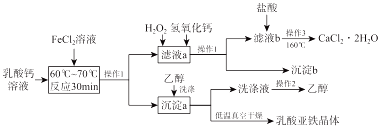
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示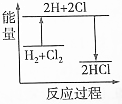 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com