
【题目】从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
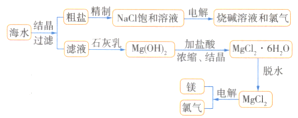
(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
【答案】![]() (或
(或![]() 、
、![]() )
) ![]() 、
、![]()
![]() 海边(或沿海陆地)
海边(或沿海陆地)
【解析】
(1)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水;
(4)从经济效益角度看,原料在海水和海滩上。
(1)用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为:![]() 或
或![]() 或
或![]() ,故答案为:
,故答案为:![]() (或
(或![]() 、
、![]() );
);
(2)海滩贝壳的主要成分为CaCO3,CaCO3在高温煅烧下分解为氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙,反应方程式为:CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3
CaO+CO2↑、CaO+H2O=Ca(OH)2,故答案为:CaCO3![]() CaO+CO2↑、CaO+H2O=Ca(OH)2;
CaO+CO2↑、CaO+H2O=Ca(OH)2;
(3)制漂白粉的方法是向石灰乳中通入氯气,反应生成次氯酸钙、氯化钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)从经济效益角度看,该化工厂厂址应选在沿海陆地,因为其原料在海水和海滩上,故答案为:海边(或沿海陆地)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和氯化钠溶液制取氢氧化钠的工艺流程:
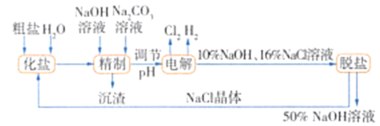
依据图中所给信息,完成下列填空:
(1)电解时发生反应的化学方程式为________________。
(2)粗盐含Ca2+、Mg2+等杂质,加入NaOH溶液、Na2CO3溶液的目的就是除去这些杂质,但如果精制时发现其中SO42-含量也较高,必须添加含钡离子的试剂除去SO42-,该试剂可以是________(填序号)。
a. Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(填序号)。
a.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
b.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
c.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼(“![]() ”前为原料,“
”前为原料,“![]() ”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
A.①②④⑥B.③④C.②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃ 时在Cu表面分解的机理如图1。已知200℃ 时:反应 I: 3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1 反应II: N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ·molˉ1,下列说法不正确的是

A.图l所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) △H=+50.7 kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量![]() 关系,判断下列说法正确的是( )
关系,判断下列说法正确的是( )
A.若![]() ,则气体的压强:甲
,则气体的压强:甲![]() 乙
乙
B.若![]() ,则气体的摩尔体积:甲
,则气体的摩尔体积:甲![]() 乙
乙
C.若![]() ,则气体体积:甲
,则气体体积:甲![]() 乙
乙
D.若![]() ,则分子数:甲
,则分子数:甲![]() 乙
乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com