
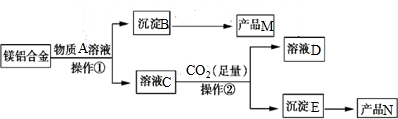
分析 Mg0和Al2O3都可与酸反应,Al2O3为两性氧化物,可与强碱反应,由题目“(3)足量CO2与溶液C发生反应生成沉淀E”可知A应为NaOH,则B为Mg0,M为Mg0,C为NaAlO2,E为Al(OH)3,分解生成的N为Al2O3,D为NaHCO3,以此解答该题.
解答 解:Mg0和Al2O3都可与酸反应,Al2O3为两性氧化物,可与强碱反应,由题目“(3)足量CO2与溶液C发生反应生成沉淀E”可知A应为NaOH,则B为Mg0,C为NaAlO2,E为Al(OH)3,分解生成的N为Al2O3,D为NaHCO3,
(1)由以上分析可知M为Mg0,A为NaOH,故答案为:Mg0;NaOH;
(2)操作①为过滤操作,用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(3)过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,离子反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)E为Al(OH)3,分解生成的N为Al2O3,方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | Kw/c(H+)=1 mol•L-1的溶液中:Na+、SiO32-、I-、CO32- | |
| B. | 氨水中:Al3+、K+、F-、NO3- | |
| C. | pH=1的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| D. | 0.1 mol•L-1的NaHSO4溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
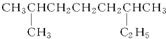 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;
;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
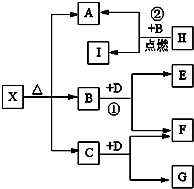 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: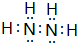 .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | c(一元酸)/mol•L-1 | c(KOH)/mol•L-1 | 反应后溶液 |
| ① | c(HX)=0.10 | 0.1 | pH=b |
| ② | c(HY)=0.10 | 0.1 | pH=7 |
| ③ | c(HZ)=0.10 | 0.1 | pH=10 |
| ④ | c(HZ)=0.20 | 0.1 | pH<7 |
| A. | 实验①反应后的溶液中:c(X-)=0.05mol•L-1或c(X-)+c(HX)=0.05mol•L-1且不小于7 | |
| B. | 实验②反应时发生的离子方程式为H++OH-═H2O,则c(K+)=c(Y-)=c(OH-)=c(H+) | |
| C. | 实验③反应后的溶液中:c(K+)=c(Z-)=10-3 | |
| D. | 实验④反应后的溶液中:c(Z-)+c(OH-)<c(K+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com