
【题目】已知某种由KCl、NaCl组成的混合物中,钾、钠离子的物质的量之比是1:2,则此混合物中,KCl的质量分数是___________.如果该混合物中含6molCl-,那么,此混合物中有NaCl__________g.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
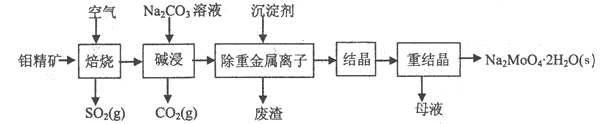
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
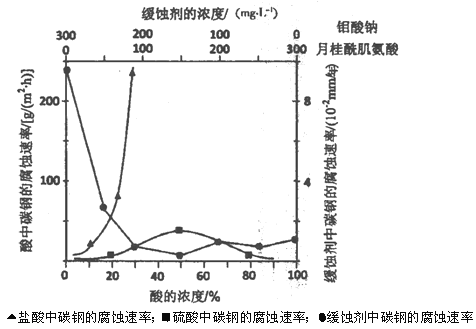
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识填空:
(1)氢氧化铁胶体制备的化学方程式_______________,所得分散系及下列物质分别用激光照射,与该分散系现象相同的是______。
A、淀粉溶液 B、澄清水 C、纳米铁 D、豆浆
(2)装置的选择:
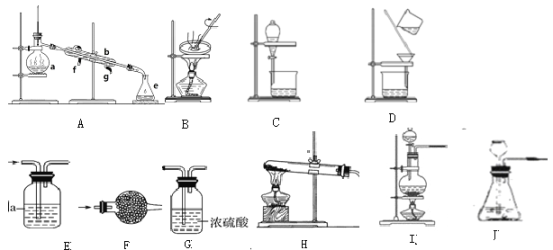
a、干燥氨气______。
b、分离植物油和水______。
c、检验CO中的是否含有CO2______。
d、分离碘和四氯化碳______。
e、实验室用氢氧化钙和氯化铵共热制氨气______。
f、实验室用稀盐酸和石制二氧化碳______。
(3)以物质的量为中心的计算
①、12.4gNa2X中含Na+0.4mol,则X的相对原子质量是______。
②、500mL质量分数为49%的硫酸溶液,密度为1.392g/cm3,则溶液的物质的量浓度为______________mol/L,其中含有SO42-的数目约为______(保留三位有效数字)。
(4)一定物质的量浓度溶液的配制:
①、实验室要配制480mL0.25mol·L-1的FeSO4溶液,需称量绿矾(FeSO4·7H2O)______g,
②、由于错误操作,使得实际浓度比所要求的偏小的是______(填写编号)。
A 称量绿矾时,左码右物
B 使用容量瓶配制溶液时,俯视液面定容,所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有干燥
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
③、定容时,若加蒸馏水时不慎超过刻度线,处理方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaSO4·2H2O受热会逐步失去结晶水。取纯净的CaSO4·2H2O固体3.44 g进行加热,测定固体质量随温度的变化情况如右图所示。C点固体的化学式是________________。T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)=![]() N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g)![]() SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。

(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甘肃马家密遗址出土的青铜刀是我国最早治炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜録”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
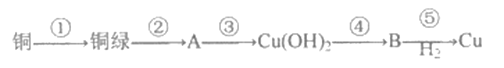
(1)从物质分类标准看,“铜绿”属于______(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:____________。
(3)请写出铜録与盐酸反应的化学方程式:________________________。
(4)上述转化过程中属于化合反应的是_______________(填序号)
II.胶体是一种常见的分散系,回答下列问题。用Fe(OH)3胶体进行下列实验:
(5)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色_______,这说明_________,这种现象称为____________________________。
(6)向其中滴入过量稀硫酸,现象是___________,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的说法中,正确的是( )
A.硅是常用的半导体材料,可用于制造光导纤维B.二氧化硅是酸性氧化物,故不与任何酸反应
C.硅酸是一种二元弱酸,其酸性强于碳酸D.制造普通玻璃的主要原料是纯碱、石灰石和石英
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
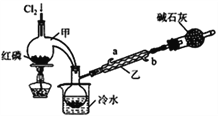
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
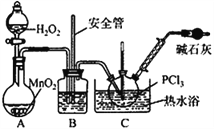
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com