
| A. | 核外电子是分层运动的,像卫星一样有确定的轨道 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域运动 |
分析 根据多电子的原子,其核外电子在原子核外按照能量的高低不同在原子核外分层运动,能量低的电子离原子核较近,而能量高的电子离原子核较远,电子的运动没有固定轨道,来分析解答.
解答 解:A、电子的运动有一定的区域,但没有固定的轨道,故A错误;
B、因核外电子的能量不同,则按照能量的高低在原子核外分层运动,故B错误;
C、多电子原子中,核外电子的能量是不同的,能量低的通常在离核较近的区域运动,能量高的电子在离核远的区域运动,故C错误;
D、多电子原子中,核外电子的能量是不同的,能量低的通常在离核较近的区域运动,能量高的电子在离核远的区域运动,故D正确.
故选D.
点评 本题考查核外电子在原子核外的运动,明确电子的能量不同、电子的运动只能用概率来描述是解答本题的关键.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:解答题

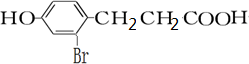 .
.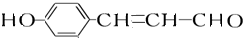 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$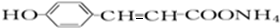 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.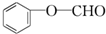 ,
,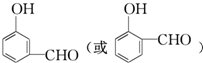 .
. +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 加压,正反应速率增大,逆反应速率减小 | |
| C. | 温度、体积不变,充入He气加压,反应速率加快 | |
| D. | 升温,混合气平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
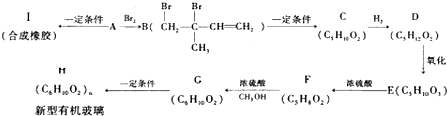
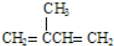 (不考虑立体异构),由G生成H的反应类型是加聚反应;
(不考虑立体异构),由G生成H的反应类型是加聚反应;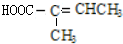 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$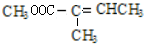 +H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);
+H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOC2H5 CH3CH2COOH | B. | 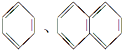 | ||
| C. | O2、O3 | D. | H、D、T |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼虾为了能长时间放置而不变质可以用适量福尔马林溶液浸泡 | |
| B. | “酸可除锈”是发生了化学变化,“洗涤剂可去油”是发生了物理变化 | |
| C. | 蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
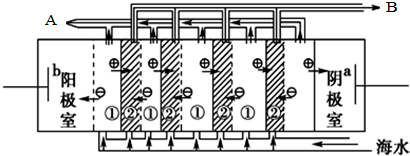
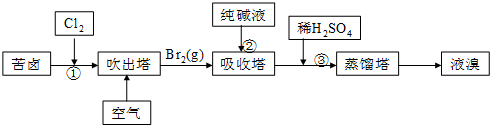
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com