
| A. | C、N、O、F | B. | Li、C、N、S | C. | Li、Na、Be、Mg | D. | F、Cl、Br、I |
科目:高中化学 来源: 题型:解答题
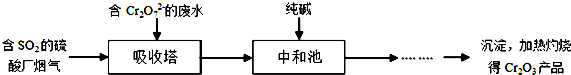
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
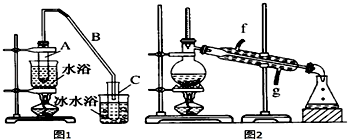

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3- | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 常温下,浓度均为0.1 mol•L-1 NaCN、NaHCO3溶液,前者的pH小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 储氢、释氢过程均无能量变化 | |
| B. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 | |
| C. | 上述储氢原理和钢瓶储氢原理相同 | |
| D. | NaHCO3含有离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com