
ЁОЬтФПЁПТШЫсМиЪЧвЛжжЧПбѕЛЏМСЃЌдкВЛЭЌЬѕМўЯТKClO3НЋKIбѕЛЏЮЊI2ЛђKIO3ЁЃФГЪЕбщаЁзщдкЪЕбщЪвжаЖдKClO3КЭKIЕФЗДгІНјааСЫЬНОПЁЃЛиД№ЯТСаЮЪЬтЃК
ЪЕбщвЛЁЁжЦШЁТШЫсМи
ЃЈ1ЃЉAжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЁЃЪЕбщПЊЪМЪБЃЌЪзЯШНјааЕФЪЕбщВНжшЪЧ________ЁЃ
ЃЈ2ЃЉAКЭBзАжУжЎМфШБЩйГ§ШЅТШЦјжаТШЛЏЧтЕФзАжУЃЌЪЧЗёЛсЖдЪЕбщНсЙћВњЩњВЛРћгАЯьЃЌЦфРэгЩЪЧ__ЃЈЬюЁАЪЧЁБЛђЁАЗёЁБЃЌШєбЁдёЁАЪЧЁБЧыЫЕУїРэгЩЃЌШєбЁдёЁАЗёЁБдђВЛашЫЕУїРэгЩЃЉ
ЪЕбщЖўЁЁТШЫсМигыЕтЛЏМиЗДгІЕФбаОП
ЃЈ3ЃЉИУаЁзщбаОПЬѕМўЖдЗДгІВњЮяЕФгАЯьЃЌЯЕСаaЪЕбщЕФМЧТМБэШчЯТЃЈЪЕбщдкЪвЮТЯТНјааЃЉЃК
ЪдЙмБрКХ | 1 | 2 | 3 | 4 |
0.20molLЉ1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3ЃЈsЃЉ/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molLЉ1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
еєСѓЫЎ/mL | 9.0 | 6.0 | 3.0 | 0 |
ЪЕбщЯжЯѓ |
ЂйЯЕСаaЪЕбщЕФЪЕбщФПЕФЪЧ__ЃЎЂкЩшМЦ1КХЪдЙмЪЕбщЕФзїгУЪЧ__ЃЎ
ЂлШє2КХЪдЙмЪЕбщЯжЯѓЪЧШмвКБфЮЊЛЦЩЋЃЌШЁЩйСПИУШмвКМгШыЕэЗлШмвКЯдРЖЩЋЃЛМйЩшбѕЛЏВњЮяЮЈвЛЃЌЛЙдВњЮяЮЊKClЃЌдђДЫЗДгІЕФРызгЗНГЬЪНЮЊ______ ЃЎ
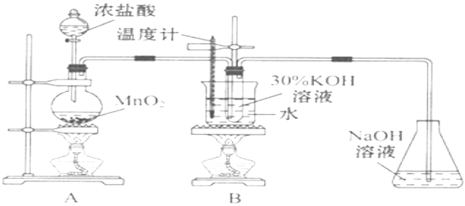
ЁОД№АИЁПMnO2+4HClЃЈХЈЃЉ![]() MnCl2+Cl2Ёќ+2H2O МьВщзАжУЦјУмад ЪЧ,ТШЦјжаЛьШыЕФТШЛЏЧтЛсгыKOHЗДгІЃЌНЕЕЭТШЫсМиЕФВњТЪ баОПЗДгІЬхЯЕжаСђЫсХЈЖШЖдЗДгІВњЮяЕФгАЯь СђЫсХЈЖШЮЊ0ЕФЖдееЪЕбщ ClO3-+6I-+6H+= Cl-+3I2+3H2O
MnCl2+Cl2Ёќ+2H2O МьВщзАжУЦјУмад ЪЧ,ТШЦјжаЛьШыЕФТШЛЏЧтЛсгыKOHЗДгІЃЌНЕЕЭТШЫсМиЕФВњТЪ баОПЗДгІЬхЯЕжаСђЫсХЈЖШЖдЗДгІВњЮяЕФгАЯь СђЫсХЈЖШЮЊ0ЕФЖдееЪЕбщ ClO3-+6I-+6H+= Cl-+3I2+3H2O
ЁОНтЮіЁП
ЪЕбщвЛЕФФПЕФЪЧжЦШЁKClO3ЃЛИљОнЪЕбщзАжУЭМЃЌдкAжаMnO2гыХЈHClЙВШШжЦCl2ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊMnO2+4HClЃЈХЈЃЉ![]() MnCl2+Cl2Ёќ+2H2OЃЛдкBжаCl2гы30%KOHШмвКЙВШШжЦKClO3ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ3Cl2+6KOH
MnCl2+Cl2Ёќ+2H2OЃЛдкBжаCl2гы30%KOHШмвКЙВШШжЦKClO3ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ3Cl2+6KOH![]() 5KCl+KClO3+3H2OЃЌгЩгкбЮЫсОпгаЛгЗЂадЃЌAжажЦЕУЕФCl2жаЛьгаHClЃЈgЃЉЃЌHClЛсЯћКФKOHЪЙKClO3ВњТЪНЕЕЭЃЌCl2дкЭЈШыBзАжУЧАвЊГ§ШЅЦфжаЕФHClЃЈgЃЉЃЛCжаNaOHШмвКЮќЪеЖргрCl2ЃЌЗРжЙЮлШОДѓЦјЁЃ
5KCl+KClO3+3H2OЃЌгЩгкбЮЫсОпгаЛгЗЂадЃЌAжажЦЕУЕФCl2жаЛьгаHClЃЈgЃЉЃЌHClЛсЯћКФKOHЪЙKClO3ВњТЪНЕЕЭЃЌCl2дкЭЈШыBзАжУЧАвЊГ§ШЅЦфжаЕФHClЃЈgЃЉЃЛCжаNaOHШмвКЮќЪеЖргрCl2ЃЌЗРжЙЮлШОДѓЦјЁЃ
ЪЕбщЖўЪЧбаОПKClO3гыKIЕФЗДгІЃЌИљОнБэжаЪ§ОнЗжЮіЃЌИїзщЪЕбщжаЪЙгУСЫЕШХЈЖШЁЂЕШЬхЛ§ЕФKIКЭЕШжЪСПЕФKClO3ЃЌH2SO4ЕФХЈЖШВЛЭЌЃЌЪЕбщЕФФПЕФЪЧЬНОПЗДгІЬхЯЕжаСђЫсХЈЖШЖдЗДгІВњЮяЕФгАЯьЃЌ1КХЪдЙмУЛгаМгСђЫсЃЌ1КХЪдЙмЮЊЖдееЪЕбщЁЃ2КХЪдЙмЪЕбщЯжЯѓЪЧШмвКБфЮЊЛЦЩЋЃЌШЁЩйСПИУШмвКМгШыЕэЗлШмвКЯдРЖЩЋЃЌЫЕУїI-БЛбѕЛЏГЩI2ЃЌKClO3ЕФЛЙдВњЮяЮЊKClЃЌИљОнбѕЛЏЛЙдЗДгІжаЕУЪЇЕчзгЪиКуКЭЕчКЩЪиКуЁЂдзгЪиКуЪщаДРызгЗНГЬЪНЁЃ
ОнЩЯЪіЗжЮіЛиД№ЁЃ
ЃЈ1ЃЉAжаMnO2гыХЈHClЙВШШжЦБИCl2ЃЌAжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊMnO2+4HClЃЈХЈЃЉ![]() MnCl2+Cl2Ёќ+2H2OЁЃЪЕбщПЊЪМЪБЃЌЪзЯШНјааЕФЪЕбщВНжшЪЧЃКМьВщзАжУЕФЦјУмадЁЃ
MnCl2+Cl2Ёќ+2H2OЁЃЪЕбщПЊЪМЪБЃЌЪзЯШНјааЕФЪЕбщВНжшЪЧЃКМьВщзАжУЕФЦјУмадЁЃ
ЃЈ2ЃЉгЩгкбЮЫсОпгаЛгЗЂадЃЌAжажЦЕУЕФCl2жаЛьгаHClЃЈgЃЉЃЌAКЭBзАжУжЎМфШБЩйГ§ШЅCl2жаHClЃЈgЃЉЕФзАжУЃЌЖдЪЕбщНсЙћЛсВњЩњВЛРћгАЯьЃЌРэгЩЪЧЃКТШЦјжаЛьШыЕФТШЛЏЧтЛсгыKOHЗДгІЃЌНЕЕЭТШЫсМиЕФВњТЪЁЃ
ЃЈ3ЃЉЂйИљОнБэжаЪ§ОнЗжЮіЃЌИїзщЪЕбщжаЪЙгУСЫЕШХЈЖШЁЂЕШЬхЛ§ЕФKIКЭЕШжЪСПЕФKClO3ЃЌH2SO4ЕФХЈЖШВЛЭЌЃЌЯЕСаaЪЕбщЕФЪЕбщФПЕФЪЧЃКбаОПЗДгІЬхЯЕжаСђЫсХЈЖШЖдЗДгІВњЮяЕФгАЯьЁЃ
Ђк1КХЪдЙмУЛгаМгСђЫсЃЌЩшМЦ1КХЪдЙмЪЕбщЕФзїгУЪЧЃКСђЫсХЈЖШЮЊ0ЕФЖдееЪЕбщЁЃ
Ђл2КХЪдЙмЪЕбщЯжЯѓЪЧШмвКБфЮЊЛЦЩЋЃЌШЁЩйСПИУШмвКМгШыЕэЗлШмвКЯдРЖЩЋЃЌЫЕУїI-БЛбѕЛЏГЩI2ЃЌKClO3ЕФЛЙдВњЮяЮЊKClЃЌЗДгІПЩаДГЩClO3-+I-+H+ЁњCl-+I2+H2OЃЌ1molClO3-ЕУЕН6molЕчзгЃЌ1molI-ЪЇШЅ1molЕчзгЃЌИљОнЕУЪЇЕчзгЪиКуХфЦНЮЊClO3-+6I-+H+ЁњCl-+3I2+H2OЃЌНсКЯдзгЪиКуЁЂЕчКЩЪиКуЃЌЗДгІЕФРызгЗНГЬЪНЮЊClO3-+6I-+6H+=Cl-+3I2+3H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГШмвКПЩФмКЌгаClЉЁЂSO42ЉЁЂCO32ЉЁЂNH4+ЁЂFe3+ЁЂFe2+ЁЂAl3+ КЭNa+ЃЎФГЭЌбЇЮЊСЫШЗШЯЦфГЩЗжЃЌШЁВПЗжЪдвКЃЌЩшМЦВЂЭъГЩСЫШчЯТЪЕбщЃКгЩДЫПЩжЊдШмвКжа

A. ШмвКжажСЩйга4жжРызгДцдкЃЌЦфжаClЉвЛЖЈДцдкЃЌЧвcЃЈClЉЃЉЁн0.2 molLЉ1
B. дШмвКжаcЃЈFe3+ЃЉ=0.2 molLЉ1
C. SO42ЉЁЂNH4+ЁЂNa+вЛЖЈДцдкЃЌCO32ЉЁЂAl3+вЛЖЈВЛДцдк
D. ШЁЩйСПдШмвКВЂМгШыKSCNШмвКЃЌГЪбЊКьЩЋЃЌЫЕУїИУШмвКвЛЖЈУЛгаFe2+ЃЌжЛгаFe3+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩ2ЁЊТШБћЭщжЦШЁЩйСПЕФ1ЃЌ2ЁЊБћЖўДМЪБЃЌашвЊОЙ§ЯТСаФФМИВНЗДгІЃЈ ЃЉ
A.МгГЩЁњЯћШЅЁњШЁДњB.ЯћШЅЁњМгГЩЁњЯћШЅ
C.ШЁДњЁњЯћШЅЁњМгГЩD.ЯћШЅЁњМгГЩЁњЫЎНт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЗжНтЕУЕНЕШЮяжЪЕФСПЕФBЁЂCЁЂDЃЌЭМжагаВПЗжЩњГЩЮяЮДБъГіЃЌЛиД№вдЯТЮЪЬтЃК

ЃЈ1ЃЉAЕФЛЏбЇЪНЮЊ_____________________________________ЁЃ
ЃЈ2ЃЉаДГіЗДгІЂкЕФЛЏбЇЗНГЬЪНЃК______________ ЗДгІЂлЕФРызгЗНГЬЪНЃК__________________
ЃЈ3ЃЉJгыFЕФЗДгІЬхЯжГіJОпга______________ЕФаджЪ
ЃЈ4ЃЉдкЗДгІЂмжаЃЌЕБЩњГЩБъПіЯТ2.24 L GЪБЃЌзЊвЦЕчзгЪ§ФПЮЊ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗЧН№ЪєдЊЫиаЮГЩЕФМђЕЅЧтЛЏЮяжаЗаЕузюИпЕФЪЧ
A. бѕ B. Зњ C. ЕЊ D. Сђ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаВйзїЛђзАжУФмДяЕНЪЕбщФПЕФЕФЪЧ(ЁЁ )

A. ХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФNaClШмвК(ШчЭМ1)
B. ХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФNaNO3ШмвК(ШчЭМ2)
C. ЖЈШн(ШчЭМ3)
D. ХфжЦ0.100 0 molЁЄL-1ТШЛЏФЦШмвКЪБ,НЋвКЬхзЊвЦЕНШнСПЦПжаашгУВЃСЇАєв§Сї
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎжаМгШыЯТСаШмвКЖдЫЎЕФЕчРыЦНКтВЛВњЩњгАЯьЕФЪЧЃЈ ЃЉ
A.FeCl2ШмвКB.Na2CO3ШмвКC.KAl(SO4)2ШмвКD.NaIШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДЮСзЫс(H3PO2)ЪЧвЛжжОпгаЧПЛЙдадЕФвЛдЊШѕЫсЃЌЙЄвЕЩЯГЃРћгУH3PO2КЭAgNO3ШмвКЗДгІНјааЛЏбЇЖЦвјЃЌвбжЊИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ4:1ЃЌдђЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. H3PO2жаСздЊЫиЕФЛЏКЯМлЮЊ+1 B. H3PO2ЕФЕчРыЗНГЬЪНЮЊH3PO2![]() H++H2PO2-
H++H2PO2-
C. H3PO2БЛAgNO3бѕЛЏГЩСЫH3PO4 D. NaH2PO2ЁЂNaH2PO4ЁЂNa2HPO4ОљЮЊЫсЪНбЮ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇгУгяБэЪОВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. ЕЊЛЏУОЃКMgN
B. Ca(OH)2ЕФЕчРыЗНГЬЪНЃКCa(OH)2=Ca2++2OH
C. жазгЪ§ЮЊ18ЕФТШдзгЃК![]()
D. ЗњЛЏФЦЕФЕчзгЪНЮЊЃК![]()
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com