
| A、常温下在水中的溶解能力AgCl>AgBr>AgI |
| B、在AgCl饱和溶液中加入饱和NaBr溶液有AgBr沉淀生成 |
| C、在AgBr饱和溶液中加入饱和NaCl溶液有AgCl沉淀生成 |
| D、将AgCl、AgBr和AgI的饱和溶液等体积混合,再加入足量的浓AgNO3,溶液,生成的AgI沉淀最多 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 序号 | 条件 | 现象 | 结论 | ||
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、HCO3-、OH- |
| B、Fe3+、Zn2+、I-、SO42- |
| C、H+、K+、NO3-、SO42- |
| D、Ca2+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 1 mol?L-1的Na2CO3溶液中离子总数为0.3NA |
| B、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA/a个碳原子 |
| C、在101kPa时,0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+20akJ?mol-1 |
| D、常温下28g14CO含有14 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、达到平衡后,若只升高温度,化学平衡正向移动 |
| B、达到平衡后,再通人稀有气体,逆反应速率增大 |
| C、使用催化剂,平衡常数不变 |
| D、0~5min内,NO的反应速率为2.4×10-3mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液可由等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合而成该溶液 |
| B、可由pH=3的HCl与pH=11的NH3?H2O溶液等体积混合而成 |
| C、若溶液中离子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) 溶液中溶质一定含有NH4Cl |
| D、加入适量NH3?H2O,溶液中离子浓度可能为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
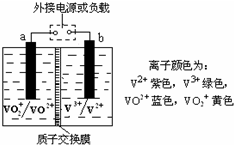 某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )
某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )| A、当右槽溶液颜色由绿色变为紫色时,电池中能量转化形式为化学能转化为电能 |
| B、充电过程中,a极的反应式为VO2+-e-+H2O=VO2++2H+ |
| C、储能电池a、b两极间的电解质溶液中通过电子的定向移动形成闭合回路 |
| D、放电时,当转移的电子数为6.02×1023时,共有1.0 mol H+从右槽迁移进入左槽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com