
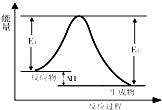
 关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )
关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D、降低反应体系温度,反应速率减慢,A的转化率增大 |


科目:高中化学 来源: 题型:
| A、Na2O2既是氧化剂,又是还原剂 |
| B、反应的氧化产物只有O2 |
| C、当反应产生标准状况下2.24LO2时,转移的电子为0.1mol |
| D、向高锰酸钾溶液中滴加浓盐酸可以得到酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、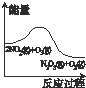 升高温度,NO2的含量减小 |
B、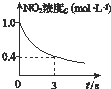 0~3 s内,反应速率为v(NO2)=0.2 mol?L-1 |
C、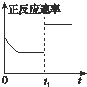 t1时仅加入催化剂,平衡正向移动 |
D、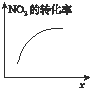 达平衡时,仅改变x,则x可能为压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
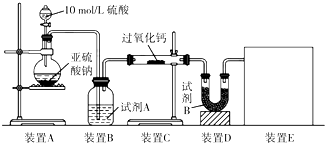 过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com