
ij��ѧ����С��������ͼװ��̽��SO2�����ʡ�
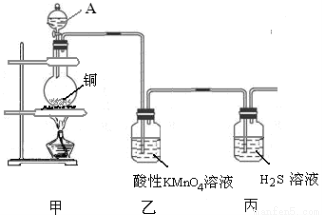
��ش��������⣺
��1��װ������A������������_____________����ƿ�ڷ�����Ӧ����ѧ����ʽΪ_____________________________________��
��2��װ�����г��ֵ�������_______________________________������֤��SO2����______������ţ���װ�ñ���������Ӧ�Ļ�ѧ����ʽΪ______________________������֤��SO2����______������ţ���
A�������� B����ԭ�� C��Ư����
��3���ռ�SO2�������ѡ���װ��Ϊ______������ţ���
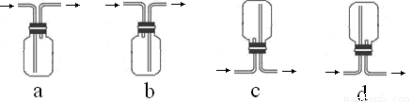
�ӻ����ĽǶȿ��ǣ��ռ�װ�õij�������Ҫ����һ��ʢ��_________���ѧʽ����Һ��ϴ��ƿ��
��1����Һ©�� Cu+2H2SO4��Ũ�� Cu SO4+SO2��+2H2O��2����Һ��ɫ B
Cu SO4+SO2��+2H2O��2����Һ��ɫ B
2H2S+ SO2=3S��+2H2O a ��3��a c NaOH
��������
�������������ƿ�з�����Ӧ��Cu+2H2SO4(Ũ)  CuSO4+ SO2��+2H2O��Cu������ƿ�У�Ũ����ͨ����Һ©�����롣������SO2�����л�ԭ�ԡ������ԡ�Ư���Լ����ԡ�������KMnO4��Һ��֤�仹ԭ�ԣ���������ɫ��dz����ɫ����Ӧ�ķ���ʽΪ��2KMnO4+5SO2+H2O=K2SO4+2MnSO4+2H2SO4 .��H2S��ˮ��Һ����֤�������ԣ������Dz�������ɫ��������Ӧ�ķ���ʽΪ2H2S+ SO2=3S��+2H2O . SO2�����ܽ���ˮ�����Բ�������ˮ���ռ���ֻ�����ſ������ռ������������ܶȱȿ���������ֻ���������ſ������ռ�������ѡ��װ��a��c���ռ���SO2�Ǵ�����Ⱦ�ֱ���ŷŻᵼ�´�����Ⱦ�����꣬������ʵ��װ�õ����װһ��β������װ�ã���������NaOH��Һ������β����
CuSO4+ SO2��+2H2O��Cu������ƿ�У�Ũ����ͨ����Һ©�����롣������SO2�����л�ԭ�ԡ������ԡ�Ư���Լ����ԡ�������KMnO4��Һ��֤�仹ԭ�ԣ���������ɫ��dz����ɫ����Ӧ�ķ���ʽΪ��2KMnO4+5SO2+H2O=K2SO4+2MnSO4+2H2SO4 .��H2S��ˮ��Һ����֤�������ԣ������Dz�������ɫ��������Ӧ�ķ���ʽΪ2H2S+ SO2=3S��+2H2O . SO2�����ܽ���ˮ�����Բ�������ˮ���ռ���ֻ�����ſ������ռ������������ܶȱȿ���������ֻ���������ſ������ռ�������ѡ��װ��a��c���ռ���SO2�Ǵ�����Ⱦ�ֱ���ŷŻᵼ�´�����Ⱦ�����꣬������ʵ��װ�õ����װһ��β������װ�ã���������NaOH��Һ������β����
���㣺����������ʶ��SO2������Ʊ����ռ������ʵ���֤��β��������֪ʶ��


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ˷���и�һ��ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ������
ʵ���ҿ�����KMnO4�����Ũ���ᷴӦ��ȡ��������Ӧ����ʽ���£�
2KMnO4��16HCl(Ũ)��2KCl��2MnCl2��5Cl2����8H2O��
�����á�˫���š��������ת�Ƶķ������Ŀ����2�֣�
�ڸ÷�Ӧ�б�������δ��������HCl�����ʵ���֮���� _______����1�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��һ�ڶ�ѧ���¿���һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij����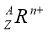 ����Ԫ��R��ԭ�������ǣ� ����
����Ԫ��R��ԭ�������ǣ� ����
A��Z B��A-Z C��Z-n D��Z+n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��һ12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��m g Na������������ȼ�գ����ɹ��������Ϊ(m��3.55 g)����m g Na��������Ӧ�����ɹ������������Ϊ����(m��0.8 g)����(m��1.0 g)����(m��1.2 g) ��(m��1.6 g)����(m��1.4 g)
A���٢� B���٢� C���ۢ� D���٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��һ12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2BrO3�� +Cl2��Br2 +2ClO3����5Cl2 +I2 +6H2O��2HIO3 +10HCl��ClO3��+5Cl��+6H+��3Cl2+3H2O�ж�����������������ǿ��˳��Ϊ
A��BrO3����ClO3����IO3����Cl2 B��BrO3����Cl2��ClO3����IO3��
C��BrO3����ClO3����Cl2��IO3�� D��Cl2��BrO3����ClO3����IO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��̨�и�һ��ѧ����ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��ȷ����
A��ͭ����Ũ���Cu + 4H+ + 2NO3-= Cu2+ + 2NO2��+ 2H2O
B���Ȼ�����Һ�������ˮ��Ӧ��Al3++4NH3��H2O= [Al(OH)4]-+4NH4+
C��������ˮ��Ӧ��Cl2+H2O��2H++Cl-+ClO-
D������SO2ͨ��Ca(ClO)2��Һ�У�SO2+H2O+Ca2++2ClO��=CaSO3��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��̨�и�һ��ѧ����ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʲ����ɵ���ֱ�ӻ��ϵõ�����
A��NaCl B��SO3 C��FeCl3 D��CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡΫ���и�һ��ѧ����ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
����֧�Թ��зֱ����������ͬ����ɫ��Һ�������²�����������ȷ����
������������
A�μ�BaCl2��Һ���ɰ�ɫ����ԭ��Һ����SO42��
B�μ���ˮ��CCl4���������²���Һ����ɫԭ��Һ����I��
C�μ�ϡNaOH��Һ����ʪ���ɫʯ����ֽ�����Թܿ���ֽ������ԭ��Һ����NH4��
D����ϡ���ᣬ������������ͨ�����ʯ��ˮ����Һ�����ԭ��Һ��һ������CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�����и�һ12���ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ��Cl��Ũ����50 mL 1 mol��L-1 AlCl3��Һ��Cl��Ũ����ȵ���
A��150 mL 1 mol��L-1��NaCl��Һ
B��75 mL 2 mol��L-1 NH4Cl��Һ
C��150 mL 2 mol��L-1��KCl��Һ
D��75 mL 1 mol��L-1��FeCl3��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com