
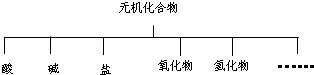
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② |
③NaOH ④KOH |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
| ||
| ||


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| n[(CN)2]/mol | 0.1 | 0.2 | 0.3 |
| c(SCN-)/mol?L-1 | 2 | a | 0 |
| c(Br-)/mol?L-1 | 1 | 1 | 1 |
| c(I-)/mol?L-1 | 1 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,A是黄绿色气体,B、C、D都是含A元素的化合物,转化关系如图所示.
常温下,A是黄绿色气体,B、C、D都是含A元素的化合物,转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中加入BaCl2,产生白色浑浊,说明该溶液中一定有SO42- |
| B、向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
| C、H3PO4能与NaCl溶液反应生成HCl,说明磷酸的酸性比盐酸强 |
| D、向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com