
【题目】某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O。并测量x值。
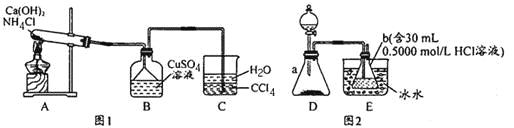
(Cu(NH3)xSO4·H2O制备)见图1
(1)A中发生的化学反应方程式为________________________________。
(2)C中CCl4的作用是______________。
(3)B中先产生蓝色沉淀,随后沉淀溶解变成深蓝色溶液,此溶液中含有Cu(NH3)xSO4,若要从溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂___________________________。
(x值的测量)见图2
步骤一:检查装置气密性,称取0.4690g晶体[M=(178+17x)g/mol]于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液至无气体产生为止
步骤三:用0.5000mol/L的NaOH标准溶液液滴定b中剩余HCI,消耗标准溶液液16.00mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为_________________。
(x值的计算与论证)
(5)计算:x=__________。
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中_____________________________________________________(任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设_______(填“成立”或“不成立”)。
(6)针对假设l,你对实验的处理意见是________________。
【答案】Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O 防止倒吸 无水乙醇 Cu(NH3)x2++2OH-=Cu(OH)2↓+xNH3↑ 3.56 加入的NaOH溶液不足、没有加热、 生成的氨气未完全逸出、NaOH溶液浓度过低等 不成立 更换砝码完好的托盘天平后,重新进行步骤一到步骤三的全部实验
2NH3↑+CaCl2+2H2O 防止倒吸 无水乙醇 Cu(NH3)x2++2OH-=Cu(OH)2↓+xNH3↑ 3.56 加入的NaOH溶液不足、没有加热、 生成的氨气未完全逸出、NaOH溶液浓度过低等 不成立 更换砝码完好的托盘天平后,重新进行步骤一到步骤三的全部实验
【解析】
(1)A中氯化铵与氢氧化钙反应生成氨气;氨气通入硫酸铜溶液,会生成氢氧化铜沉淀,氨气过量,沉淀又溶解;
(2)氨气极易溶于水,难溶于四氯化碳;
(3)Cu(NH3)xSO4H2O在乙醇中的溶解度较小;
(4)Cu(NH3)xSO4与NaOH反应生成氢氧化铜沉淀和氨气;
(5)Cu(NH3)xSO4H2O与氢氧化钠反应生成的氨气被盐酸吸收,再用氢氧化钠滴定剩余的盐酸,根据消耗的氢氧化钠求出与氨气反应的盐酸,以及氨气的物质的量,根据晶体与氨气的物质的量的关系求出x;
若生成的氨气偏少或氨气没有完全逸出,则氨气的物质的量偏小,x值偏小;
若步骤三中测定结束读数时,体积读数偏小,则与氢氧化钠反应的盐酸偏少,与氨气反应的盐酸偏多,计算出的氨气的物质的量偏大。
(1)A中是Ca(OH)2和NH4Cl发生反应,反应的化学方程式为:
Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,会产生倒吸,用CCl4可以让氨气溶于水时不在导管中进行,可以达到防止倒吸的目的;
(3)要从溶液中析出Cu(NH3)xSO4·H2O晶体,就要减少溶解度,可以加入无水乙醇。
(4)Cu(NH3)xSO4中可以和NaOH反应的是Cu2+,碱性溶液中NH3溶解度小,故会生成NH3,Cu(NH3)x2+是络合物,不能写成离子形式,故离子方程式为:Cu(NH3)x2++2OH-=Cu(OH)2↓+xNH3↑;
(5)0.5000mol/L的NaOH标准溶液液滴定b中剩余HCI,消耗标准溶液液16.00mL,则与氨气反应盐酸的物质的量为:0.5000mol/L×0.014L=0.007mol,那么氨气的物质的量为0.007mol,则有0.469x/(178+17x)=0.007,得x=3.56;提出测量值比理论值偏小,是因为氨气的量偏少,那么造成氨气的量偏小的操作可能有:加入的NaOH溶液不足、没有加热、生成的氨气未完全逸出、NaOH溶液浓度过低等;步骤三中测定结束读数时,体积读数偏小,则与NaOH反应的盐酸较少,那么与氨气反应的盐酸就多,结果就会偏大,故假设不成立;
(6)假设1是天平砝码腐蚀缺损,那么最好处理是更换砝码完好的托盘天平后,重新进行步骤一到步骤三的全部实验。


科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
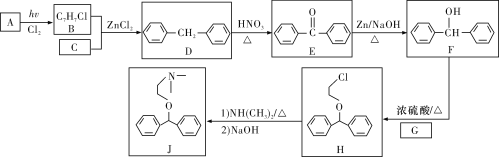
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___,H中的官能团名称是_______。
(2)由E生成F的反应类型是______,G的结构简式为______。
(3)A→B的化学方程式为_____。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
)结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为_____。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选)。____
的合成路线(其他无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 53g碳酸钠中含NA个CO32—B. 0.1molOH—含NA电子
C. 1.8g重水(D2O)中含NA个中子D. 标准状况下11.2L臭氧(O3)中含NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是:
A.氢气燃烧热为285.5kJ·mol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5 kJ·mol-1
B.等pH的强碱与弱碱,稀释相同的倍数,弱碱pH值偏小
C.中和热的实验过程中,环形玻璃搅拌棒如果用铜代替,则测量出的中和热数值偏小
D.已知N2(g)+3H2(g)![]() 2 NH3(g) ;△H=-92.4kJ·mol-1,则在一定条件下将1molN2和4molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
2 NH3(g) ;△H=-92.4kJ·mol-1,则在一定条件下将1molN2和4molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
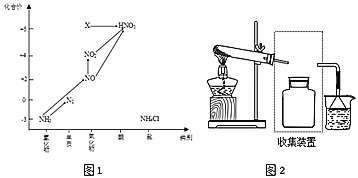
(1)图1中,X的化学式为_____,从化合价上看,X具有______性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为__________。
②下列试剂不能用于干燥NH3的是__________(填字母)。
A.浓硫酸 B.碱石灰 C.生石灰
③若要收集一瓶氨气,采用的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
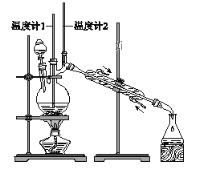
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)![]() (指出所含官能团名称)_____________________
(指出所含官能团名称)_____________________
(2)相对分子质量为72且沸点最低的烷烃的习惯名称是________________________________
(3) 写出3,3—二甲基丁酸的结构简式______________________________
(4)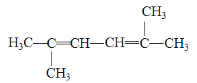 的系统命名为________________________;
的系统命名为________________________;
(5)合成高聚物![]() 其单体的键线式___________________________________
其单体的键线式___________________________________
(6)甲苯可用于制造烈性炸药TNT,该反应的化学方程式为__________________________________________
(7)某烃的结构式用键线式可表示为![]() ,若该烃与Br2发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有__________种。
,若该烃与Br2发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质,化合物之间的转化关系图,有些反应中的部分物质被唔去,常温常压下:A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应![]() 均为工业上的重要反应:
均为工业上的重要反应:
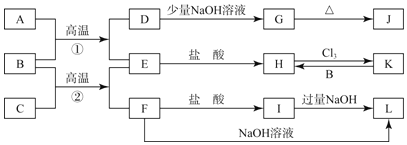
请回答下列问题:
(1)![]() 的化学式为 ______ .
的化学式为 ______ .
(2)写出C和NaOH溶液反应生成L的离子方程式: ______ ;
(3)写出B与C高温反应生成E和F的化学方程式: ______ ;
(4)写出D与J的稀溶液反应生成G的离子方程式: ______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1mol·L-1的富马酸(H2A)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)[ δ(X)= ![]() ]随pH的变化如图所示。下列叙述正确的是( )
]随pH的变化如图所示。下列叙述正确的是( )
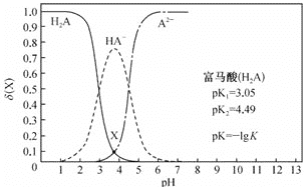
A.pH=3.05时,c(H2A)=c(HA-)=c(OH-)B.pH=4.0时, c(HA-)>C(H2A)>c(A2-)
C.常温下,反应HA-+OH-![]() A2-+H2O的pK=9.51D.常温下,图中x点处:1g
A2-+H2O的pK=9.51D.常温下,图中x点处:1g![]() =0.72
=0.72
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com