
| A. | 物质在反应中失去电子,该物质是氧化剂 | |
| B. | 置换反应一定属于氧化还原反应 | |
| C. | 氧化还原反应的本质是元素化合价的升降 | |
| D. | 发生反应时,电子不可以在同种元素间转移 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:填空题
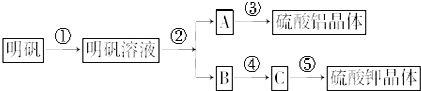
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
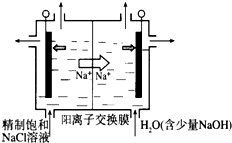
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | ||
| 若a>b | ||
| 若a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
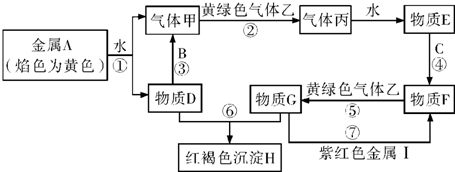
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
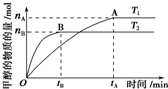 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com