
| A. | a=b=c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
分析 碳酸根离子和铵根离子相互促进水解,亚铁离子抑制铵根离子水解,铵根离子水解程度越大,相同c(NH4+)的溶液中溶质的浓度越大.
解答 解:(NH4)2SO4、(NH4)2CO3、(NH4)2Fe (SO4)2三种溶液中,碳酸根离子促进铵根水解,亚铁离子抑制铵根离子水解,相同浓度的这几种溶液中铵根离子浓度大小是(NH4)2Fe (SO4)2>(NH4)2SO4>(NH4)2CO3,如(NH4)2SO4、(NH4)2CO3、(NH4)2Fe (SO4)2三种溶液中c (NH4+)相等,则这几种溶液的浓度大小顺序是b>a>c,故选C.
点评 本题以溶液浓度大小比较为载体考查了盐类水解,明确离子之间是相互促进水解还是相互抑制水解是解本题关键,再结合电解质的强弱来分析解答,也可以采用逆向思维方法分析,难度中等.


科目:高中化学 来源: 题型:解答题
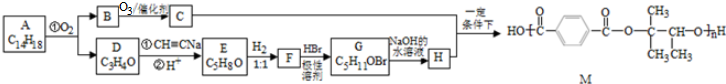
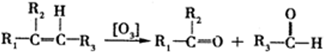
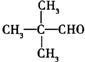
 ,D的化学名称是丙酮.
,D的化学名称是丙酮.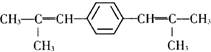 .
. .
. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
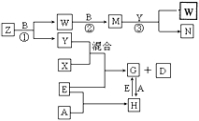 (2)反应③中被氧化的物质与被还原的物质的物质的量之比为2:1
(2)反应③中被氧化的物质与被还原的物质的物质的量之比为2:1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖溶液加入稀硫酸共热后,加入银氨溶液,水浴加热,检验水解产物具有还原性 | |
| B. | 在气体发生装置上直接点燃甲烷时,必须先检验甲烷的纯度 | |
| C. | 不慎将苯酚溶液沾到皮肤上,要立即用强碱溶液冲洗 | |
| D. | 为提纯蛋白质,可向鸡蛋清溶液中加入醋酸铅溶液,然后将所得沉淀滤出重新溶于水,即得较纯的蛋白质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LH2 中含分子数为NA | |
| B. | 46gNO2 和N2O4混合气体中含有原子数为3NA | |
| C. | 1L1mol/L氨水溶液中离子总数为2NA | |
| D. | 1L2mol/L氯化铵溶液中有2NA个NH4+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的非金属元素都分布在p区 | |
| B. | 在CaO和SiO2晶体中都不存在单个小分子 | |
| C. | 单质中一定含有非极性键 | |
| D. | C2H6是碳链为直线型的非极性分子,可推测C3H4也是碳链为直线型的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、B两点气体的颜色:A浅,B深 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
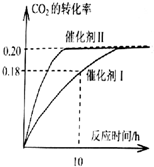 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com