
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是
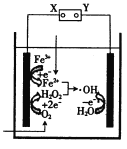
A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
科目:高中化学 来源: 题型:
【题目】铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________;其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)2 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________。
写出一种与NH4+互为等电子体的分子的电子式:________________________________。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________。CO的沸点高于N2的原因是_________________________。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏加德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________;1cm3晶体的平均质量为___________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 4.6g NO2(g)和N2O4(g)的混合物中含有0.3NA个原子
B. 0.1mol乙酸与足量乙醇发生酯化反应,生成0.1NA个乙酸乙酯分子
C. 常温下将5.6gFe投入足量浓硫酸,电子转移数为0.3NA
D. Na2O2与足量H2O发生反应,每生成2.24L气体(标准状况),电子转移数0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如下图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法不正确的是( )

A. 放电时电池总反应是4Na+3CO2 = 2Na2CO3+C
B. “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C
C. “呼出”CO2时钠箔电极反应式是Na++e-=Na
D. 每“呼出”22.4LCO2,转移电子数为4/3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.干冰升华和液氯气化时要破坏不同的微粒间作用力
B.CO2和SiO2具有相同的化学键类型和晶体类型
C.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
D.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.天然蛋白质水解的最终产物都是氨基酸
B.经紫外线长时间照射后的蛋白质仍然具有生理活性
C.在蛋白质溶液中加入福尔马林(甲醛溶液)后产生沉淀,再加入大量水,沉淀又溶解
D.在蛋白质溶液滴加饱和硫酸铵溶液可以使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2 和AlCl3的混合溶液aL,将它平均分成两份。一份滴加稀硫酸,使钡离子完全沉淀,另一份滴加AgNO3溶液,使氯离子完全沉淀。反应中消耗x mol H2SO4,y mol AgNO3溶液。据此得知原混合溶液中的铝离子浓度为( ) mol/L。
A. (y-2x)/a B. (y-x)/a C. 2(y-2x)/3a D. (y-2x)/3a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的熔、沸点有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛地存在于自然界中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com