
| A. | 蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏石油时,应使温度计水银球插入液面以下 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 | |
| D. | 检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液 |
分析 A.蒸发结晶时应有较多固体是停止加热用余热蒸干;
B.根据温度计在蒸馏装置中的位置与作用来回答;
C.上层液体从上口倒出;
D.稀硝酸能把SO32- 氧化为SO42-,从而干扰SO42- 的检验.
解答 解:A.蒸发结晶一般都不蒸干,因为溶液中会有杂质离子,如果蒸干的话,杂质也会跟着析出,从而降低纯度,故A错误;
B.在蒸馏装置中,因温度计测量的是蒸汽的温度,故应放在支管口,故B错误;
C.分液漏斗的使用原则:分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.检验 SO42- 时要避免 SO32- 的影响,就不要加入稀硝酸,因为稀硝酸能把SO32- 氧化为SO42-,从而干扰SO42- 的检验,故D错误.
故选C.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


科目:高中化学 来源: 题型:解答题
 ,ZO3-的空间构型是平面三角形;
,ZO3-的空间构型是平面三角形;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al>Mg=Fe>Na | B. | Al=Mg=Fe=Na | C. | Na>Al>Mg>Fe | D. | Al=Mg=Fe<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1 mol•L-1的溶液中:NH${\;}_{4}^{+}$、Al3+、Cl-、NO${\;}_{3}^{-}$ | |
| B. | 有大量NO${\;}_{3}^{-}$存在的强酸性溶液中:NH${\;}_{4}^{+}$、Ba2+、Fe3+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变红的溶液中:ClO-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
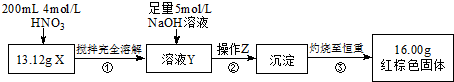
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com