
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
【答案】 2SO2 + CO2-3 + H2O = 2HSO3- + CO2 安全瓶,防止倒吸 在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4 0.16 偏低
【解析】(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为2SO2 +CO32- +H2O=2HSO3- +CO2;(2)由于SO2或CO2与氢氧化钠溶液反应时容易倒吸,所以装置Y的作用是安全瓶,防止倒吸;(3)由于在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4,所以实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4。(4)①由题设滴定反应的化学方程式知,样品中抗氧化剂的残留量(以SO2计算)与I2的物质的量之比为1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.025L=0.0025mol,残留量=![]() =0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。
=0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。


科目:高中化学 来源: 题型:
【题目】从薄荷油中得到一种烃A(C10H16),叫α非兰烃,与A相关反应如下:

已知: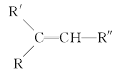
![]()

(1)B所含官能团的名称为____________。
(2)含两个—COOCH3基团的C的同分异构体共有________种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的同分异构体的结构简式为______________。
(3)B→D,D→E的反应类型分别为______________、____________。
(4)G为含六元环的化合物,写出其结构简式:______________。
(5)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。
(6)写出E→F的化学反应方程式:___________________________________。
(7)A的结构简式为____________,A与等物质的量的Br2进行加成反应的产物共有________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)滤液Ⅰ中的阴离子有 ____________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为________________;
(3)E可作为建筑材料,化合物C是______,写出由D制备冰晶石的化学方程式_____________;
(4)已知:Kw=1.0×1014,Al(OH)3![]() AlO-2+ H+ + H2O K=2.0×1013。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO-2+ H+ + H2O K=2.0×1013。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体场理论认为,基态离子的 d 轨道存在未成对电子时,d 电子发生 d-d 跃迁是金属阳离子在水溶液中显色的主要原因。下列水溶液有颜色的是
A.KSCNB.Fe(SCN)3C.Ni(SCN)2D.Zn(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。

(1)写出乙酸与乙醇发生酯化反应的化学方程式______________________________。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是________(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是_________________________。
(4)饱和Na2CO3溶液的作用是__________________________________________________________________________________________________________________________________。
II.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是__________、_______。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的________________,__________________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.2mol/LCaCl2溶液中含Cl-数为0.4NA
B. 标准状况下,1.12LH2S气体分子中含0.5NA个质子
C. 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
D. 标准状况下,分子的数目为0.2NA的H2O的体积是4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用湿润的淀粉—KI试纸检验Cl2: Cl2+2I-= 2 Cl-+I2
B. 工业固氮:N2+3H2![]() 2NH3
2NH3
C. 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D. 铝热法焊接铁轨:2Fe+Al2O3![]() 2Al+Fe2O3
2Al+Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断错误的是( )
A. NA个H+的质量为1 g
B. 2 L 0.5 mol/L Na2SO4溶液中含NA个Na+
C. 32 g O2中含有2NA个氧原子
D. 标准状况下,1 mol H2O中含有NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含有某种官能团的芳香烃C8H8为主要原料合成药物E的流程(部分反应条件及产物略去)如下:

已知:
请根据流程图中转化关系回答下列问题:
(1)芳香烃C8H8的结构简式为_____________,名称为_________________。
(2)反应②的反应类型为_________________。
(3)B中所含官能团的名称为____________________________。
(4)D转化为E的化学方程式为_____________________,该反应的反应类型为_____________。
(5)同时满足下列条件的C的同分异构体有_______________种。
①遇FeCl3溶液发生显色反应;
②既能发生水解反应也能发生银镜反应;
③苯环上只有两个取代基。
写出其中核磁共振氢谱峰面积之比为1∶1∶2∶2∶2∶2的有机物结构简式∶__________________。
(6)参照上述流程,写出用CH3CH2OH为原料(其它无机试剂任选)制备化合物CH2=CHCOOCH2CH3 的合成路线__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com