【答案】
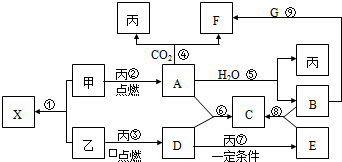
分析:A、F的焰色反应为黄色说明AF中含有钠元素,甲和乙是单质,点燃条件下都可以燃烧,说明丙为O
2;判断甲为钠,A为Na
2O
2;反应④可知,F为碳酸钠;B为氢氧化钠,G为二氧化碳;乙为非金属,X和A摩尔质量相同,乙、丙两元素在周期表中位于同一主族,则乙为硫元素;X为Na
2S;D为二氧化硫,E为三氧化硫,A+D→C;A为过氧化钠,和二氧化硫反应生成硫酸钠C;B+E→C,B是氢氧化钠,C为硫酸钠;依据判断出的物质进行分析判断.
解答:解:甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、F的焰色反应为黄色说明AF中含有钠元素,甲和乙是单质,点燃条件下都可以燃烧,说明丙为O
2;判断甲为钠,A为Na
2O
2;反应④可知,F为碳酸钠;B为氢氧化钠,G为二氧化碳;乙为非金属,X和A摩尔质量相同,乙、丙两元素在周期表中位于同一主族,则乙为硫元素;X为Na
2S;D为二氧化硫,E为三氧化硫,A+D→C;A为过氧化钠,和二氧化硫反应生成硫酸钠C;B+E→C,B是氢氧化钠,C为硫酸钠;
(1)丙和E的化学式为:丙:O
2;E为SO
3;故答案为:O
2;SO
3;
(2)X为硫化钠,离子化合物,电子式为:

,G是二氧化碳,结构式为O=C=O,所以空间构型为直线型,故答案为:

;直线型;
(3)反应⑤是过氧化钠和水反应,反应的化学反应方程式为:2Na
2O
2+2H
2O═4NaOH+O
2↑,
故答案为:2Na
2O
2+2H
2O═4NaOH+O
2↑
(4)B溶液为氢氧化钠与G是二氧化碳反应生成F为碳酸钠的离子方程式为:CO
2+2OH
-═CO
32-+H
2O,
故答案为:CO
2+2OH
-═CO
32-+H
2O;
(5)上图①-⑨的反应中,①,②,③都是化合反应,④⑤⑥⑦是氧化还原反应,⑧⑨是复分解反应,所以不属于氧化还原反应的是⑧⑨,故答案为:⑧⑨;
(6)将8g 乙(S)在足量丙(O
2)中燃烧,所得气体D(SO
2)物质的量为0.25mol,通入100mL 3.5mol?L
-1的B(NaOH)溶液中n(NaOH)=0.35mol,完全吸收后依据二氧化硫和氢氧化钠物质的量判断,n(SO
2):n(NaOH)=0.25mol:0.35mol=5:7,1:2<n(SO
2):n(NaOH)<1:1,判断二氧化硫和氢氧化钠生成了亚硫酸钠和亚硫酸氢钠,直平法写出化学方程式为:
5SO
2+7NaOH=2Na
2SO
3+3NaHSO
3+2H
2O,计算得到溶液中的溶质及其物质的量分别为:0.15mol NaHSO
3和0.1 mol Na
2SO
3,若同体积的气体D(SO
2)n(SO
2)=0.25mol,通入100mL 2.5mol?L
-1的B(NaOH)溶液中,n(NaOH)=0.25mol,依据二氧化硫和氢氧化钠物质的量之比判断产物,n(SO
2):n(NaOH)=0.25mol:0.25mol=1:1,说明反应二氧化硫全部反应生成亚硫酸氢钠,完全吸收后,亚硫酸氢钠溶液中电离大于水解,所含离子的物质的量浓度由大到小的顺序为:c(Na
+)>c(HSO
3-)>c(H
+)>c(SO
32-)>c(OH
-),
故答案为:0.15mol NaHSO
3和0.1 mol Na
2SO
3 ;c(Na
+)>c(HSO
3-)>c(H
+)>c(SO
32-)>c(OH
-).
点评:本题考查了物质转化关系和物质性质的综合应用,主要考查钠及其化合物的性质应用,结构分析,化学方程式的书写,二氧化硫与碱反应量不同产物不同的判断,溶液中离子浓度大小的比较,综合性强,难度较大.


 ,G是二氧化碳,结构式为O=C=O,所以空间构型为直线型,故答案为:
,G是二氧化碳,结构式为O=C=O,所以空间构型为直线型,故答案为: ;直线型;
;直线型;