
| A. | 地下钢管连接锌板 | B. | 汽水底盘喷涂高分子膜 | ||
| C. | 铁件镀铜 | D. | 金属护拦表面涂漆 |
分析 金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析解答.
解答 解:金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,
A.地下钢管连接锌板,Zn、Fe形成原电池,Zn为负极被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,故A正确;
B.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B错误;
C.铁件镀铜,阻止Fe与空气、水接触,从而防止金属被腐蚀,故C错误;
D.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故D错误;
故选A.
点评 本题考查了金属的腐蚀与防护,侧重考查基础知识与基本能力,明确原电池原理即可解答,题目难度不大.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:选择题
| A. | 将28.6 g Na2CO3•10H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L Na2CO3溶液 | |
| B. | 可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大 | |
| C. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| D. | 金属Mg与CO2和稀硫酸均能反应,其反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 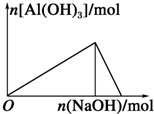 向AlCl3溶液中滴加NaOH溶液 | B. |  向NaOH溶液中滴加AlCl3溶液 | ||
| C. | 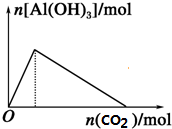 向NaAlO2溶液中滴加CO2 | D. |  向AlCl3溶液中滴氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
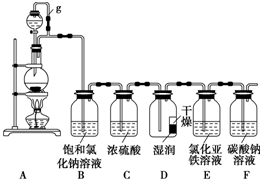
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,达平衡后再充入N2O4气体,NO2百分含量变小 | |
| B. | 增大压强,平衡向正反应方向移动,混合气体颜色变浅 | |
| C. | 达平衡后,升高温度,△H减小 | |
| D. | 2v正(NO2)═v逆(N2O4)说明反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com