
【题目】下列物质中:只存在共价键的是(填序号,下同),既存在离子键又存在极性共价键的是 , 只存在离子键的是 .
①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4 .
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 纯碱、烧碱均属于碱 B. SiO2、SO2均属于酸性氧化物
C. 凡能电离出H+的化合物均属于酸 D. 盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是
A.2 min末时A和B的浓度之比为5∶3 B.x=1
C.前2 min,A的消耗浓度为0.5 mol·L-1 D.2 min末时B的浓度为1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )。
A. 950 mL 111.2 g B. 500 mL 117 g
C. 1 000 mL 117 g D. 任意规格 111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的有机物可用C6H10O5表示[交换膜分别是只允许阴(阳) 离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是
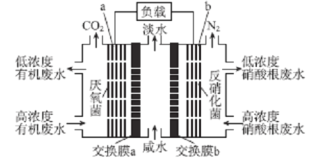
A.电池工作时,电子由a极经导线流向b极
B.交换膜a是阴离子交换膜
C.电极 b 的反应式:2NO3-+l0e-+12H+=N2↑+6H2O
D.相同时间内(相同状况下)生成CO2和N2的体积比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+ ![]() Fe2++Cr3+。下列说法正确的是
Fe2++Cr3+。下列说法正确的是
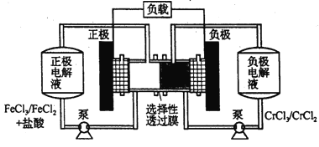
A.氧化性:Cr3+ >Fe3+
B.电池放电时,负极的电极反应式为:Fe2+-e-=Fe3+
C.充电时,阴极的电极反应式为:Cr3+ +e-= Cr2+
D.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.8gFe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中c(NO3)=0.85 mol/L
B.反应后的溶液最多还能溶解1.4 gFe
C.反应后溶液中铁元素可能以Fe2+形式存在
D.1.12L气体可能是NO、NO2的混合气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com