
|
�����йؽ�����ȷ���� | |
| [����] | |
A�� |
T��ʱ��Ba(OH)2��Һ��c(H+)��c(OH��)��10��12����pH��8�ĸ���Һ��������pH��4�����ᣬ����ҺpH��7 |
B�� |
pH��ȵ����ᡢ���ᡢ���ᣬ��ϡ��1000����ϡ�ͺ�pH�����Ǵ��� |
C�� |
0.2 mol/L����HA��Һ��0.1 mol/L��NaOH��Һ�������ϣ����Һ�ڳ���ʱpHһ��С��7 |
D�� |
��0.1 mol/L�����������Һ�и�����Ũ�ȹ�ϵ�ǣ�c(H+)��c(SO42��)��c(NH4+)��c(OH��) |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
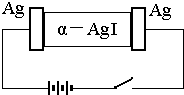 ��-AgI��һ�ֹ��嵼�壬�����ʺܸߣ�Ϊ�о� ��-AgI ������ Ag+���绹�� I-���磬�������ͼʵ�飬�����йؽ�����ȷ���ǣ�������
��-AgI��һ�ֹ��嵼�壬�����ʺܸߣ�Ϊ�о� ��-AgI ������ Ag+���绹�� I-���磬�������ͼʵ�飬�����йؽ�����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��T��ʱ��Ba��OH��2��Һ��c��H+��?c��OH-��=10-12����pH=8�ĸ���Һ��������pH=4�����ᣬ����ҺpH=7 | B��pH��ȵ����ᡢ���ᡢ���ᣬ��ϡ��1000����ϡ�ͺ�pH�����Ǵ��� | C��0.2mol/L��HA��Һ��0.1mol/L��NaOH��Һ�������ϣ����Һ�ڳ���ʱpHһ��С��7 | D����0.1mol/L�����������Һ�и�����Ũ�ȹ�ϵ�ǣ�c(H+)��c(SO42-)��c(NH4+)��c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������Ԫ�����ڱ����й�֪ʶ���ش��������⣺����Ԫ�ص�������Ҫ����ԭ�ӵ������������͵��Ӳ�����������Ԫ�ص�����������Ϊm�����Ӳ���Ϊn��һ����������Ĺ��ɣ�m��n��Ԫ��Ϊ�ǽ���Ԫ�أ�m��n��Ԫ��Ϊ����Ԫ�ء�
6.�����йؽ�����ȷ����( )
A.����Ԫ�ص���������ԭ�����ĵ������������Ա仯
B.Ԫ�صĽ�������ǽ����Եݱ�������������ǵ�������Ԫ�غ͵ڢ�A��Ԫ��
C.��A��͢�A��Ԫ�صĵ���һ�㶼û��ͬ��������
D.ԭ���������������ڵ��Ӳ�����Ԫ�ؾ�Ϊ����Ԫ��
7.�����ƶϷ���ʵ�ʵ���( )
A.��n���ڵ����һ�ֽ���Ԫ�ش��ڵ�n����(n��1)
B.��n������8-n�ַǽ���Ԫ��(n��1,����ϡ������Ԫ��)
C.m=1��m=7��Ԫ�ص��������ʱ�����γ����ӻ�����
D.m-n=5������Ԫ�ش�����ǿ�Ķ�Ӧ�����m-n=-5��Ԫ�ض�Ӧ���������ˮ��������ǿ�ļ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������ʡ�����еڶ�ʮ��ѧ�����߿��캽���ԣ�������ѧ�Ծ����������� ���ͣ���ѡ��
�����йؽ�����ȷ����
| A��T��ʱ��Ba��OH��2��Һ��c��H+����c��OH-��=10-12����pH=8�ĸ���Һ��������pH=4�����ᣬ����ҺpH=7 |
| B��pH��ȵ����ᡢ���ᡢ���ᣬ��ϡ��1000����ϡ�ͺ�pH�����Ǵ��� |
| C��0.2mol��L��HA��Һ��0.1mol��L��NaOH��Һ�������ϣ����Һ�ڳ���ʱpHһ��С��7 |
| D����0.1mol��L�����������Һ�и�����Ũ�ȹ�ϵ�ǣ�c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ�����и����߿��캽���ԣ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йؽ�����ȷ����
A��T��ʱ��Ba��OH��2��Һ��c��H+����c��OH-��=10-12����pH=8�ĸ���Һ��������pH=4�����ᣬ����ҺpH=7
B��pH��ȵ����ᡢ���ᡢ���ᣬ��ϡ��1000����ϡ�ͺ�pH�����Ǵ���
C��0.2mol��L��HA��Һ��0.1mol��L��NaOH��Һ�������ϣ����Һ�ڳ���ʱpHһ��С��7
D����0.1mol��L�����������Һ�и�����Ũ�ȹ�ϵ�ǣ�c(H+)>c(SO42-)>c(NH4+)>c(OH-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com