
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。
资料支持:
Cu2O在酸性溶液中会发生反应:Cu2O + 2H+ == Cu + Cu2+ + H2O。
方案一:
(1)学生甲取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出样品中一定含有 ,写出产生上述气体的化学方程式
(2)进一步探究样品中另一种成分。实验操作步骤为:取少量(1)步骤溶液,____________________________________________________________________。
方案二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 。
A.若固体全部溶解,说明样品一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
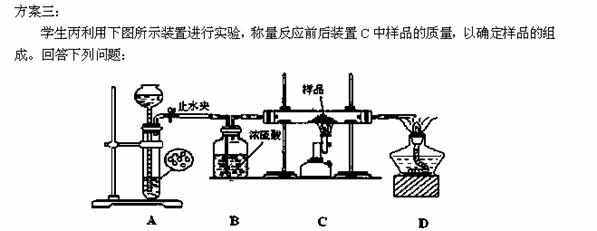
(4)装置A是氢气的发生装置,可以使用的药品是____________
A.氢氧化钠溶液和铝片 B.稀硝酸和铁片
C.稀硫酸和锌片 D.浓硫酸和镁片
(5)下列实验步骤的先后顺序是____________________(填序号)。
①打开止水夹; ②关闭止水夹; ③点燃C处的酒精喷灯;
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯。
(6)假设样品全部参加反应,若实验前样品的质量为1.6克,实验后称得装置C中固体的质量为1.3克。则样品的组成是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
浊液中分散质粒子的直径______(填“>”或“<”)100nm,溶液中分散质粒子的直径______(填“>”或“<”)1nm,而胶体颗粒的直径介于______之间。这个尺寸与现代材料科学中______的直径大致相当,从而使胶体的研究更具有现实意义。布朗运动______(“是”或“不是”)胶体的特有性质。
查看答案和解析>>
科目:高中化学 来源: 题型:
合理选择饮食、正确使用药物是保证身心健康的重要方面。请回答:
(1)富含蛋白质的食物,如肉、蛋、奶属于 (填“酸性”或“碱性”)食物;
(2)青霉素是常用的抗生素,使用该药前一定要进行 ;
(3)某些微量元素、维生素摄入不足会引起疾病,例如铁元素摄入量不足可能会导致 ;

(4)食品添加剂可以改善食物的色香味。右图是某鲜橙汁包装上的说明,下列配料属于食品添加剂的是 (填字母)。
A.纯净水 B.天然食用香料
查看答案和解析>>
科目:高中化学 来源: 题型:
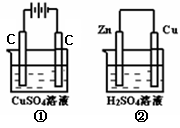
右图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化。下列叙述正确的是
A.产生气体体积:①=②
B.溶液的pH变化:①②均减小
C.电极反应式:①中阳极为4OH――4e—=2H2O+O2↑,②中负极为2H++2e—=H2↑
D.①中阴极质量增加,②中正极质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
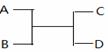
已知A 、B、C、D之间的转化关系如右图所示。下列说法正确的是
A.若A为Na,D为氢气,则B一定为水
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是 ( )
A.体积相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是 ( )
A.依据电荷守恒,推测一定存在K+和NH4+
B.100mL溶液中含0.01mol CO32-
C.Ba2+一定不存在,Mg2+可能存在
D.2.33g沉淀中含BaCO3和BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
铁明矾[xFeSO4·yAl2(SO4)3·zH2O]是一种重要化工原料。其组成可通过下列实验测定。
①称取1.8520 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0100 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,则应保持溶液中c(Ba2+)≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com