
.已知短周期元素的离子aA2+、bB+、cC3-、dD -都具有相同的电子层结构,则下列叙述中正确的是
-都具有相同的电子层结构,则下列叙述中正确的是
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.元素的第一电离能:A>B>D>C |
科目:高中化学 来源: 题型:阅读理解
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |


查看答案和解析>>
科目:高中化学 来源:2012届浙江省东阳市高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高。试回答下列各题:
(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成两种分子的离子方程式_______________________________________。
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程_______________________________________________________
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式______________________________。
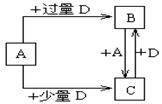 (4)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
(4)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离
子浓度由大到小的顺序为____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省眉山市洪雅中学高三(上)期中化学试卷(解析版) 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |

查看答案和解析>>
科目:高中化学 来源:2011届山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是 ,F的电子式是 。
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的
化学方程式: 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8 mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4 mol/L,此时反应v正 v逆(填“>”、“<”或“=”)。 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度 (填“增大”、“不变”或“减小”),B的转化率
_。(填“升高”、“不变”或“降低”),L的体积分数 (填“增大”、“不变”、“减小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com