
【题目】指甲花中存在的β-紫罗蓝酮属于一种萜类化合物,可作为合成维生素A的原料。下列有关β-紫罗蓝酮的说法正确的是
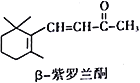
A. β-紫罗蓝酮的分子式为C10H14O
B. 分子中所有碳原子可能处于同一平面
C. 与足量的H2反应后,分子中官能团的种类减少一种
D. 和酸性KMnO4溶液、溴的四氯化碳溶液发生的反应类型相同
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 醋酸钠、纯碱、盐酸和生石灰分别属于酸、碱、盐和氧化物
B. 汽油、酶和纤维素分别属于油脂、蛋白质和多糖
C. 只要功夫深,铁杵磨成针和野火烧不尽,春风吹又生分别是化学变化、物理变化
D. 石墨、水银、氯化钠分别属于非金属单质、金属单质、电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
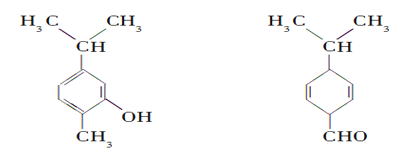
A. 不是同分异构体
B. 分子中共平面的碳原子数相同
C. 均能与溴水反应
D. 可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示,请回答下列问题:

(1)B的结构式为___ . D的物质的名称是___ .
(2)在①~④反应中,属于加成反应的是___(填反应序号).
(3)写出下列反应的化学方程式:
反应①___;反应②___;反应③___ .
(4)实验室用如图2所示装置进行反应④.
a.反应④的化学方程式是___ .
b.试管乙中应加入___,乙中的导管不能伸入到液面下的原因是___ .
c.实验完成后,从试管乙中分离出有机物C的方法是___ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)基态Ti 原子的价层电子排布图为________________________。
(2)在TiO、TiN、TiS2、TiCl4等化合物中,S、Cl的电负性大小:S________Cl (填“>”、“<”或“=”)。O、N 的第一电离能大小为O < N,原因是___________________________。
(3)TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4,该晶体是_______ 晶体。TiCl4中加入大量水,同时加热,可制得二氧化钛的水合物(TiO2·xH2O),再经焙烧可得TiO2,写出生
成二氧化钛水合物(TiO2·xH2O)的化学方程式_________________________________。
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图1所示,其化学式为_____________。阴离子SO42-中硫原子的杂化方式为______________,写出一种与SO42-互为等电子体的分子_____________。
(5)下图2是钛晶体在空间的一种堆积方式,此堆积方式叫______________,钛原子的配位数为____________。已知:a=0.295 nm,c=0.469nm,则该钛晶体的密度为_________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
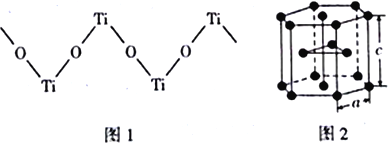
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g) ![]() 2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
A. 2molH2(g)和1molI2(g) B. 3molHI(g)
C. 2molH2(g)和2molI2(g) D. 1molI2(g)和2molHI(g)[来科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4).再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
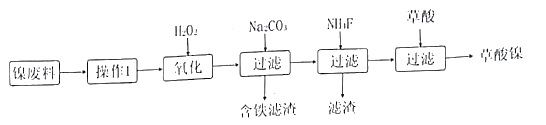
请回答下列问题:
(1)操作I为____。加入H2O2发生的主要反应的离子方程式为_____;加入碳酸钠溶液调节pH至4.0一5.0,其目的为______。
(2)若加入NH4F时滤液中c(Mg2+)=0.02 mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO -,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____。
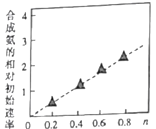
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com