
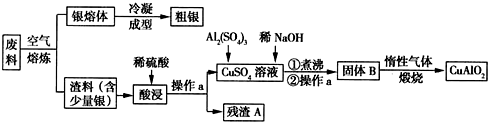
分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水;增大接触面积,加快反应速率;
(2)CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,配平完成方程式;
(3)Ag与稀硝酸反应生成硝酸银、NO与水;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,据此计算氧气物质的量,再计算需要氧气的体积,结合空气中氧气体积分数计算需要空气体积;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag的质量与Cu质量之差,根据电子转移守恒计算Cu放电时析出Ag的质量,即为两个电极上银质量的变化值之差.
解答 解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:Cu;CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤;由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:过滤;4; 2; 4CuAlO2;O2;
(3)Ag与稀硝酸反应生成硝酸银、NO与水,反应方程式为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,故消耗氧气物质的量为$\frac{nmol×1}{4}$=0.25n mol,标况下需要氧气的体积为0.25n mol×22.4L/mol=5.6n L,需要空气的体积为5.6n L÷20%=28n L,
故答案为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;28n;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:正;43.2g.
点评 本题以从废料中回收银并制备铜化工产品载体,考查化学工艺流程、物质分离提纯、电解原理、氧化还原反应配平与计算,(3)(5)中计算抓住电子转移守恒进行解答,难度较大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的化学活泼性:W<X<Y<Z | B. | 单质的氧化能力:W>X>Y>Z | ||
| C. | 原子最外层电子数:W<X<Y<Z | D. | 元素的最高化合价:W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
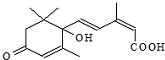
| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 分子中有三种官能团 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
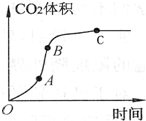 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是盐酸消耗完 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com