
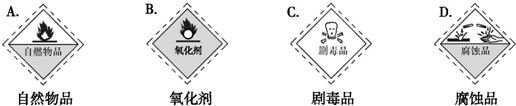
分析 (1)依据浓硫酸具有强烈的腐蚀性、强氧化性选择标签;
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,无水硫酸铜溶于水生成蓝色的硫酸铜溶液,据此解答;
(3)硫与浓硫酸反应生成二氧化硫和水;铜与浓硫酸反应,与稀硫酸不反应;
(4)该过程中不生成有毒气体二氧化硫;使用硫酸的量少;
(5)Cu作还原剂,双氧水作氧化剂,发生氧化还原反应生成硫酸铜;
解答 解:(1)浓硫酸具有强烈的腐蚀性、强氧化性,所以选择的标签为BD,
故答案为:BD;
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,无水硫酸铜溶于水得到蓝色溶液,看到现象为沉淀中白色物质溶解,溶液变蓝色;则所得白色固体为CuSO4;
故答案为:沉淀中白色物质溶解,溶液变蓝色;CuSO4;
(3)硫与浓硫酸反应生成二氧化硫和水,化学方程式:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应,铜与浓硫酸反应,与稀硫酸不反应;
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O; 随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应;
(4)依据方程式可知:产生等量的硫酸铜,乙消耗的硫酸更少,而且不产生污染物SO2;
故答案:产生等量的硫酸铜,乙消耗的硫酸更少;不产生污染物SO2;
(5)铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,是发生了氧化还原反应所致,该反应为Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O.
点评 本题考查了浓硫酸的性质,明确浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦⑧ | B. | ②③④⑦ | C. | ②③⑤⑥ | D. | ①④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ④⑥ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电路中每转移12mol电子,最多有1molCr2O${\;}_{7}^{2-}$被还原 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电解过程中溶液pH不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 350 | 54.0 | a | b |
| 415 | c | 40.0 | d |
| 550 | e | f | 36.0 |
| A. | b>e | B. | 415℃、2.0MPa时B的转化率为60% | ||
| C. | 该反应的△H>0 | D. | 平衡常数K(550℃)>K(350℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com