
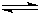 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是( )

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
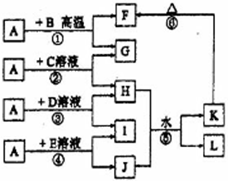 (2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
(2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 4 |
| a2 |
| 4 |
| a2 |
| △ |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol H2已耗尽 | B、3 mol I2(g)已耗尽 | C、HI的物质的量等于4 mol | D、HI的物质的量少于4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
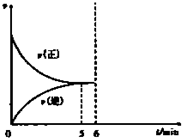 向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:
向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com