
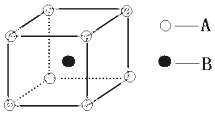
 根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).
根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).  津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应物的转化率越小 | B. | K与反应物的浓度有关 | ||
| C. | K与生成物的浓度有关 | D. | K与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448 kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H-O键比H-N键弱 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
按要求对下图中两极进行必要的联接并填空:
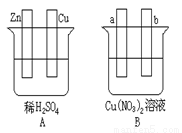
(1)在A图中,使铜片上冒H2气泡。请加以必要联接,电极反应式:锌板: ;铜板: 。
(2)在B图中,a和 b都是石墨电极,使a极析出铜,加以必要的联接后,电极反应式,a极: b极: 。经过一段时间后,停止反应后加入一定量的 ,溶液能恢复至与电解前完全一致。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com