
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 将1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
分析 A.亚硫酸根离子具有还原性,能被硝酸氧化为硫酸根离子,同时产生NO;
B.计算出偏铝酸钠和氯化氢的物质的量,然后根据过量情况判断反应产物;
C.氨水为弱电解质,不能溶解氢氧化铝,Al2(SO4)3溶液中加入过量氨水反应生成氢氧化铝和硫酸铵;
D.铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,加入过量Ba(OH)2溶液,过量的氢氧根离子和铵根离子结合生成一水合氨,氢氧化铝沉淀溶解,生成硫酸钡沉淀.
解答 解:A.亚硫酸根离子具有还原性,能被硝酸氧化为硫酸根离子,同时产生NO,反应的实质是:3SO32-+2H++2NO3-=2NO↑+H2O+3SO42-,故A错误;
B.AlO2-与H+按物质的量1:1反应转化为Al(OH)3,1molAl(OH)3消耗3molH+,反应生成等量的铝离子,过量的H+再将一半Al(OH)3转化为Al3+,1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合,二者的物质的量比为2:3,反应离子方程式为:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+,故B正确;
C.Al2(SO4)3溶液中加入过量氨水反应生成氢氧化铝和硫酸铵,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液,过量的氢氧根离子和铵根离子结合生成一水合氨,离子反应为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应考查,选项B为易错点,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
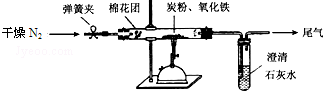
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
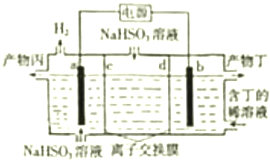
| A. | a极为阴极 | |
| B. | d为阴离子交换膜 | |
| C. | b极反应式为:HSO3-+H2O-2e-═SO42-+3H+ | |
| D. | 产物丙为硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(NH4+)+c(H+)>c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③② | B. | ①③④② | C. | ①④③② | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com