
【题目】![]() 下列物质中,既含有极性共价键,又含有非极性共价键的是______
下列物质中,既含有极性共价键,又含有非极性共价键的是______
A.![]() B.
B.![]() C.
C.![]()
![]()
![]() 某离子晶体晶胞的结构如图1所示,
某离子晶体晶胞的结构如图1所示,![]() 位于立方体中心,
位于立方体中心,![]() 位于立方体顶点。该晶体的化学式为______
位于立方体顶点。该晶体的化学式为______

A.![]()
![]() C.
C.![]()
![]()
![]() 下列物质性质的变化规律与键能无关的是______
下列物质性质的变化规律与键能无关的是______
A.热稳性:![]()
B.熔、沸点:金刚石![]() 晶体硅
晶体硅
C.熔点:![]()
D.熔、沸点:![]()
![]() 、S、Se是同一主族元素,请回答下列问题:
、S、Se是同一主族元素,请回答下列问题:
![]() 、S、Se的电负性由大到小的顺序是______。
、S、Se的电负性由大到小的顺序是______。
![]() 是______分子
是______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() ,中心原子的轨道杂化类型为______,
,中心原子的轨道杂化类型为______,![]() 分子的立体构型名称是______。
分子的立体构型名称是______。
![]() 的沸点高于
的沸点高于![]() 的沸点,其原因是______。
的沸点,其原因是______。
![]() 与
与![]() 分子互为等电子体的阴离子为______
分子互为等电子体的阴离子为______![]() 填化学式
填化学式![]() 。
。
![]() 已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
![]() 离化合物
离化合物![]() 的晶胞如图所示,
的晶胞如图所示,![]() 的配位数是______;若阿伏加德罗常数值为
的配位数是______;若阿伏加德罗常数值为![]() ,晶胞参数为anm,列式计算晶体的密度
,晶胞参数为anm,列式计算晶体的密度![]() ______
______![]() 只列式,不用计算最后结果
只列式,不用计算最后结果![]() 。
。

【答案】![]()
![]()
![]()
![]() 极性
极性 ![]() V形
V形 ![]() 分子之间形成氢键,
分子之间形成氢键,![]() 分子之间为范德华力,氢键比范德华力更强
分子之间为范德华力,氢键比范德华力更强 ![]()
![]() 2
2 ![]()
![]()
【解析】
![]() 根据形成化学键的元素性质分析化学键的类型;
根据形成化学键的元素性质分析化学键的类型;
![]() 根据晶胞的结构计算晶胞中原子数目,进而确定化学式;
根据晶胞的结构计算晶胞中原子数目,进而确定化学式;
![]() 根据晶体类型与物质的熔沸点等性质的关系分析解答;
根据晶体类型与物质的熔沸点等性质的关系分析解答;
![]() 根据元素周期律比较电负性;根据分子空间构型分析分子的极性;根据等电子体的概念书写对应的等电子体;根据核外电子排布规律书写核外电子排布式;
根据元素周期律比较电负性;根据分子空间构型分析分子的极性;根据等电子体的概念书写对应的等电子体;根据核外电子排布规律书写核外电子排布式;
![]() 由晶胞结构,用均摊法计算晶胞中Na、O原子数目,计算晶胞质量及密度。
由晶胞结构,用均摊法计算晶胞中Na、O原子数目,计算晶胞质量及密度。
![]() 中C、O原子之间形成极性键;
中C、O原子之间形成极性键;![]() 中碳原子之间形成非极性键,C原子与H原子之间形成极性键;
中碳原子之间形成非极性键,C原子与H原子之间形成极性键;![]() 中O、H原子之间形成极性键;
中O、H原子之间形成极性键;![]() 中氯离子与铵根离子之间形成离子键,铵根离子中N、H原子之间形成极性键,故答案为:B;
中氯离子与铵根离子之间形成离子键,铵根离子中N、H原子之间形成极性键,故答案为:B;
![]() X处于体心,晶胞中X数目为1,Y处于晶胞顶点,晶胞中Y原子数目
X处于体心,晶胞中X数目为1,Y处于晶胞顶点,晶胞中Y原子数目![]() ,故X、Y原子数目之比
,故X、Y原子数目之比![]() :1,故化学式为
:1,故化学式为![]() ,故答案为A;
,故答案为A;
![]() A.键能越大,共价键越稳定,氢化物越稳定,故A不符合;
A.键能越大,共价键越稳定,氢化物越稳定,故A不符合;
B.二者均为原子晶体,键能越大,破坏共价键需要能量越高,熔沸点越高,故B不符合;
C.金属离子晶体,金属键越强,破坏金属键需要能量越高,熔点越高,故C不符合;
D.均属于分子晶体,分子间作用力影响熔沸点,与键能无关,故D符合,
故答案为D;
![]()
![]() 同主族自上而下电负性减小,故电负性:
同主族自上而下电负性减小,故电负性:![]() ,故答案为:
,故答案为:![]() ;
;
![]() O原子形成2个
O原子形成2个![]() 键,还有2对孤电子对,杂化轨道数目为4,O原子杂化方式为
键,还有2对孤电子对,杂化轨道数目为4,O原子杂化方式为![]() ,
,![]() 是V形结构,分子中正负电荷重心不重合,属于极性分子,故答案为:极性;
是V形结构,分子中正负电荷重心不重合,属于极性分子,故答案为:极性;![]() ;V形;
;V形;
![]() H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强,故H2O的沸点高于H2S的沸点,故答案为:H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强;
H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强,故H2O的沸点高于H2S的沸点,故答案为:H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强;
![]() 与H2S分子互为等电子体的阴离子可以用N原子与1个单位负电荷替换O原子,等电子体为:
与H2S分子互为等电子体的阴离子可以用N原子与1个单位负电荷替换O原子,等电子体为:![]() 等,故答案为:
等,故答案为:![]() ;
;
![]() 原子比O原子多2个电子层,处于第四周期VIA族,基态Se原子核外电子排布式为
原子比O原子多2个电子层,处于第四周期VIA族,基态Se原子核外电子排布式为![]() ,4p轨道有2个未成对电子,故答案为:
,4p轨道有2个未成对电子,故答案为:![]() ;2;
;2;
![]() 由晶胞结构,以上底面面心
由晶胞结构,以上底面面心![]() 研究,与之距离相等且最近的
研究,与之距离相等且最近的![]() 为晶胞上层的4个
为晶胞上层的4个![]() 、上一个晶胞下层的4个
、上一个晶胞下层的4个![]() ,即
,即![]() 的配位数是8;晶胞中Na原子数目为8、O原子数目
的配位数是8;晶胞中Na原子数目为8、O原子数目![]() ,晶胞质量
,晶胞质量![]() ,晶体密度
,晶体密度![]()
![]() ,故答案为:8;
,故答案为:8;![]() 。
。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应![]() 常用于制作印刷线路板。
常用于制作印刷线路板。
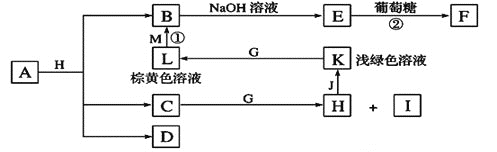
请回答下列问题:
(1)![]() 元素在周期表中的位置______________________,C的电子式______________。
元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________![]() 填写元素符号
填写元素符号![]() 。
。
(3)写出实验室制备G的离子反应方程式:_________________________________。
(4)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为![]() ,其俗名为____________。
,其俗名为____________。
(5)实验室中检验L溶液中的阳离子常选用__________![]() 填化学式
填化学式![]() 溶液,现象是__________________________________________。
溶液,现象是__________________________________________。
(6)![]() 中包含X、Y、Z元素,A的化学式为_________________________________。
中包含X、Y、Z元素,A的化学式为_________________________________。
(7)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
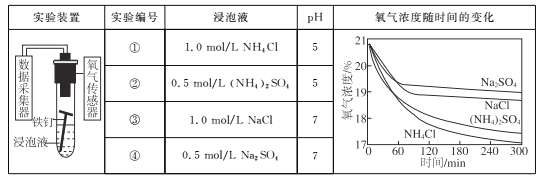
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) ![]() CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度

③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )
A.升高温度,该反应的平衡常数增大
B.由图乙信息,从11 min起其他条件不变,压缩容器的体积,则n(N2)的变化曲线为d
C.由图乙信息,10 min内该反应的平均速度v(H2) = 0. 09 mol·L-l·min-l
D.图丙中温度T1 < T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)只用水就能鉴别的一组物质是______
a.苯、乙酸、四氯化碳 b.乙醇、乙醛、乙酸
c.乙醛、乙二醇、硝基苯 d.苯酚、乙醇、甘油
(2)现有化合物:甲: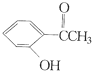 乙:
乙: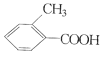 丙:
丙: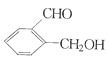
①请写出丙中含氧官能团的名称:____。
②请判别上述哪些化合物互为同分异构体:____(填代号)。
(3)A和B两种物质的分子式都是C7H8O芳香族化合物,它们都能跟金属Na反应放出H2;A不溶于NaOH溶液而B能溶于NaOH溶液,B能使FeCl3溶液显紫色,A不能;B苯环上的一溴代物有两种结构。则A和B的名称及结构简式为:A_____,B_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O+6KI+7H2SO=Cr2(SO)+7H2O+3I+4K2SO,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___(保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___,水电离出的c(H+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
![]() 下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是_______
下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是_______![]() 填选项字母
填选项字母![]() 。
。
![]()
A.![]()
![]()
![]()
![]()
![]() 相同压强下,HF、HCl、HBr的沸点由高到低的顺序为_________,原因为_______。
相同压强下,HF、HCl、HBr的沸点由高到低的顺序为_________,原因为_______。
![]() 元素可形成多种重要化合物,如
元素可形成多种重要化合物,如![]() 、
、![]() 、
、![]() 等。其中
等。其中![]() 的VSEPR模型为_____________;
的VSEPR模型为_____________;![]() 中N原子的杂化形式为__________;
中N原子的杂化形式为__________;![]() 中
中![]() 键与
键与![]() 键的数目之比为_________。
键的数目之比为_________。
![]() 组成
组成![]() 的原子的第一电离能由小到大的顺序为___________
的原子的第一电离能由小到大的顺序为___________![]() 用元素符号表示
用元素符号表示![]() ;其中三种原子基态时所含未成对电子数最多的是_________
;其中三种原子基态时所含未成对电子数最多的是_________![]() 填元素符号
填元素符号![]() 。
。
![]() 的立方晶胞结构如图所示,其中
的立方晶胞结构如图所示,其中![]() 采用简单立方堆积。
采用简单立方堆积。

![]() 与
与![]() 紧邻的F原子个数为__________。
紧邻的F原子个数为__________。
![]() 若晶胞参数为
若晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体密度为_______
,则晶体密度为_______![]() 用含a、
用含a、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com