
| A、HX | B、HY |
| C、MOH | D、NOH |


科目:高中化学 来源: 题型:
| A、2-甲基-2-丁烯 |
| B、3-甲基-1-丁炔 |
| C、2-甲基-2-丁炔 |
| D、2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| B、0.1 mol/L的醋酸的pH=a,0.01 mol/L的醋酸的pH=b,则a+1>b |
| C、pH=12的KOH溶液与pH=12 Ba(OH)2的溶液中,c(KOH):c[Ba(OH)2]=1:1 |
| D、0.1 mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雨后彩虹”、“海市蜃楼”都与胶体的光学现象有关 |
| B、硫酸钡在医疗上可用作检杳肠胃的内服药剂,俗称“钡餐” |
| C、工业制取硫酸的设备依次是沸腾炉、接触室、吸收塔 |
| D、向某无色溶液中加入BaC12溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:
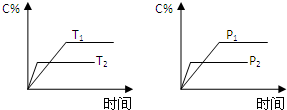 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A、达平衡后,减少A的量有利于平衡向右移动 |
| B、达平衡后,若升温,平衡左移 |
| C、化学方程式中b>c+d |
| D、达平衡后,加入催化剂则C%增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量氯气通入溴化亚铁溶液中:2Fe2++Cl2═2Cl-+2Fe3+ |
| B、三氯化铁溶液中滴入碘化钾溶液:Fe3++2I-═Fe2++I2 |
| C、氯化铜溶液中加入铁:Fe+Cu2+═Fe3++Cu |
| D、H2S通入FeCl3溶液中:H2S+2Fe3+═2Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com