
| A. | 烧碱溶液 | B. | 浓氨水 | C. | 铁粉 | D. | 硫酸 |
分析 除去FeSO4溶液中的Fe2(SO4)3和 CuSO4,杂质离子为铁离子和铜离子,根据除杂原则,除去杂质,不能够引进新的杂质,最佳试剂为铁粉,发生反应的离子方程式为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,可见加入过量铁粉,反应后没有引进杂质,通过过滤可以得到纯净的硫酸亚铁.
解答 解:根据离子反应方程式:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,除去FeSO4溶液中的硫酸铁和硫酸铜杂质,可以向硫酸亚铁溶液中加入过量的铁粉,将铁离子、铜离子杂质除去,不会引进新的杂质,而NaOH、浓氨水与CuSO4反应,加入硫酸不能除去杂质,
故选C.
点评 本题考查了铁盐和亚铁盐的转化、物质的提纯和除杂,为高频考点,注意除杂方法的原则:①若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法;②应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”;③先考虑物理方法,再用化学方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
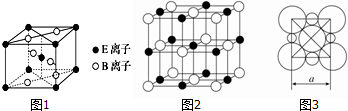
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

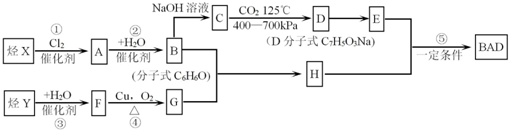
 .
. .
.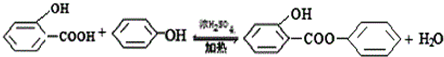 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种核素 | |
| B. | ${\;}_{77}^{192}$Ir和${\;}_{77}^{193}$Ir是两种元素 | |
| C. | Ir是主族元素 | |
| D. | 由${\;}_{77}^{193}$Ir经过中子辐射后获得${\;}_{77}^{192}$Ir是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com