

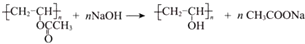
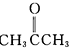 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是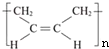 .
. 分析 乙炔与丙酮发生加成反应生成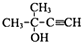 ,结合A的分子式可知,
,结合A的分子式可知, 与氢气按1:1发生加成反应,可知A为
与氢气按1:1发生加成反应,可知A为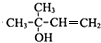 ,A在浓硫酸、加热条件下发生消去反应生成异戊二烯,异戊二烯发生加聚反应得到PI(
,A在浓硫酸、加热条件下发生消去反应生成异戊二烯,异戊二烯发生加聚反应得到PI(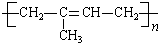 ).由PVB的结构、结合信息及C的组成,逆推可知D为
).由PVB的结构、结合信息及C的组成,逆推可知D为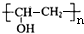 ,则C为
,则C为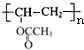 ,B为CH2=CHOOCCH3.
,B为CH2=CHOOCCH3.
解答 解:乙炔与丙酮发生加成反应生成 ,结合A的分子式可知,
,结合A的分子式可知, 与氢气按1:1发生加成反应,可知A为
与氢气按1:1发生加成反应,可知A为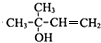 ,A在浓硫酸、加热条件下发生消去反应生成异戊二烯,异戊二烯发生加聚反应得到PI(
,A在浓硫酸、加热条件下发生消去反应生成异戊二烯,异戊二烯发生加聚反应得到PI(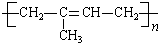 ).由PVB的结构、结合信息及C的组成,逆推可知D为
).由PVB的结构、结合信息及C的组成,逆推可知D为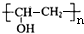 ,则C为
,则C为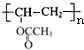 ,B为CH2=CHOOCCH3.
,B为CH2=CHOOCCH3.
(1)A为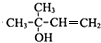 ,含有的官能团为:碳碳双键、羟基,
,含有的官能团为:碳碳双键、羟基,
故答案为:碳碳双键、羟基;
(2)反应⑤属于加成反应,上述转化中①②属于加成反应,
故答案为:①②;
(3)反应③是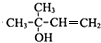 在浓硫酸、加热条件下发生消去反应生成异戊二烯,
在浓硫酸、加热条件下发生消去反应生成异戊二烯,
故答案为:浓硫酸、加热;
(4)E是A(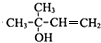 )的同分异构体,E的核磁共振氢谱显示有2种不同化学环境的氢,且E能发生银镜反应,则E为(CH3)3CCHO,E发生银镜反应的化学方程式是:(CH3)3CCHO+2Ag(NH3)OH$\stackrel{△}{→}$(CH3)3CCOONH4+3NH3+2Ag↓+H2O,
)的同分异构体,E的核磁共振氢谱显示有2种不同化学环境的氢,且E能发生银镜反应,则E为(CH3)3CCHO,E发生银镜反应的化学方程式是:(CH3)3CCHO+2Ag(NH3)OH$\stackrel{△}{→}$(CH3)3CCOONH4+3NH3+2Ag↓+H2O,
故答案为:(CH3)3CCHO+2Ag(NH3)OH$\stackrel{△}{→}$(CH3)3CCOONH4+3NH3+2Ag↓+H2O;
(5)反应⑦的化学方程式是: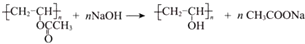 ,
,
故答案为: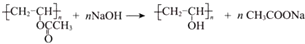 ;
;
(6)2分子乙炔之间也可以发生类似⑤的加成反应得到链烃,则反应产物的结构简式是:CH2=CH-C≡CH,
故答案为:CH2=CH-C≡CH;
(7)依照PI的合成路线,若将反应①中的反应物“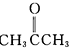 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是:
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是: ,
,
故答案为: .
.
点评 本题考查有机物的推断,充分利用转化中有机物的结构与分子式采用正逆相结合的方法进行推断,较好的考查学生放学推理能力、知识迁移运用能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
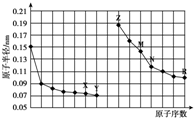
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | 简单离子的半径:M<Z<X | |
| D. | X、N两种元素组成的化合物一定不与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
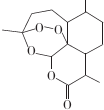
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可发生取代反应 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
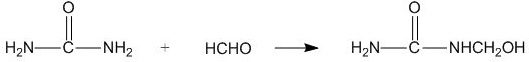
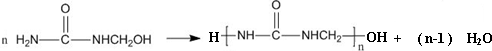
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 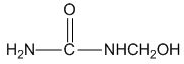 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
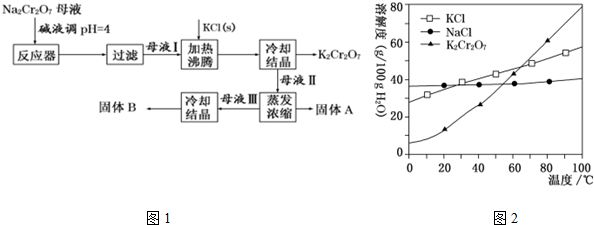
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

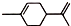 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为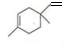 .
.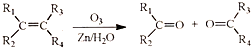 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)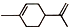 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式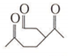 .
.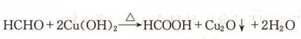 .
.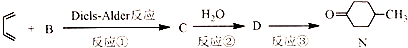
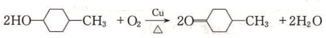 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com