
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为______________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是______(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。
③V1和V2的关系:V1___V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/L KSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2mol/LFe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式_____________。
②步骤3中现象a是_____________。
③用化学平衡原理解释步骤4的实验现象___________。
【答案】 CH3COOH![]() CH3COO-+H+ b、c I 0.1mol/L醋酸溶液 < c(CH3COO-)>c(Na+)>c(H+)>c(OH-) Fe3++3SCN-
CH3COO-+H+ b、c I 0.1mol/L醋酸溶液 < c(CH3COO-)>c(Na+)>c(H+)>c(OH-) Fe3++3SCN-![]() Fe(SCN)3 出现白色沉淀 AgSCN(s)
Fe(SCN)3 出现白色沉淀 AgSCN(s)![]() Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-===AgI↓,AgSCN的溶解平衡正向移动
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-===AgI↓,AgSCN的溶解平衡正向移动
【解析】试题分析:(1)①醋酸是一元弱酸,在溶液中存在电离平衡,则醋酸在水溶液中的电离方程式为CH3COOH![]() CH3COO-+H+。②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,答案选bc。
CH3COO-+H+。②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,答案选bc。
(2)①醋酸是弱酸,0.1mol/L醋酸溶液的pH大于1,则滴定醋酸的曲线是I。
②盐酸和氢氧化钠溶液均是一元的强酸和强碱,在浓度相等的条件下对水的电离程度影响是相同的。醋酸是一元弱酸,在浓度与盐酸相等的条件下,溶液中氢离子浓度小,对水的电离程度影响小于盐酸,则滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol/L醋酸。
③氢氧化钠和醋酸恰好反应时生成的醋酸钠水解溶液显碱性,要满足溶液显中性,则醋酸应该过量。而氢氧化钠与盐酸恰好反应时生成的氯化钠不水解,溶液显中性,所以V1小于V2。
④M点时醋酸过量,溶液是由等浓度的醋酸钠和醋酸构成的,溶液显酸性,则对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(3)①铁离子与KSCN溶液反应使溶液显红色,反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。
②硝酸银溶液能与KSCN溶液反应产生白色沉淀,所以向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液时溶液中仍然会出现白色沉淀。
③根据以上分析可知溶液中存在平衡AgSCN(s)![]() Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A. 10∶1 B. 1∶10
C. 1∶100 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)黑色固体A加热至红热投入无色溶液B中发生如下转化关系,已知X是两种气体组成的混合气体,其中一种为红棕色气体。
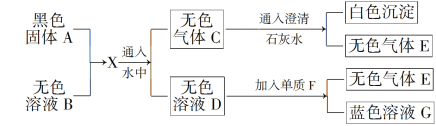
(1)由此可以推断:A为________,B为________,C为________,E为________。
(2)写出D与F反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中, 正确的是 ( )
A.离子化合物中可能含共价键B.共价化合物中可能含离子键
C.离子化合物中只含离子键D.只含共价键的物质一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3 .
A.碱①④
B.纯净物③④⑤
C.盐①⑥
D.混和物②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。下列说法不正确的是( )
A. C、D、G三种元素形成的盐,水溶液可能呈碱性
B. A与B能形成离子化合物A5B,且既含有离子键又含有共价键
C. B、C、G的简单氢化物中C的氢化物稳定性最强
D. D、E、F、G形成的简单离子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为:2Br﹣+Cl2=2Cl﹣+Br2 , 下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com