
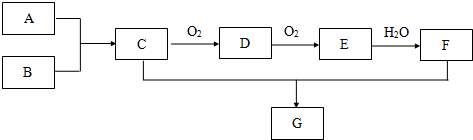
分析 A为密度最小的气体单质,A为H2,E为红棕色气体,E为NO2,根据物质的转化图,得出D为NO,F为HNO3,A+B→C反应类型是化合反应,再根据前面的推断得出B为N2,C为NH3,G为NH4NO3,据此解答.
解答 解:A为密度最小的气体单质,A为H2,E为红棕色气体,E为NO2,根据物质的转化图,得出D为NO,F为HNO3,A+B→C反应类型是化合反应,再根据前面的推断得出B为N2,C为NH3,G为NH4NO3.
(1)由上述分析可知,G的化学式是NH4NO3,故答案为:NH4NO3;
(2)A和B反应生成C的化学方程式为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$ 2NH3,故答案为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$ 2NH3;
(3)NH3是中学学过的唯一显碱性的气体,不能使湿润的蓝色石蕊试纸变色,检验NH3的存在可以用湿润的红色石蕊试纸(红→蓝)、浓盐酸(白色烟),因此bc正确,故选:bc;
(4)将盛满气体E的大试管倒扣在盛水的水槽中,发生反应的化学方程式为:3NO2+H2O=2HNO3+NO,现象为:试管内液面上升至距试管底约三分之一处,气体由红棕色变成无色,
故答案为:3NO2+H2O=2HNO3+NO;试管内液面上升至距试管底约三分之一处,气体由红棕色变成无色;
(5)CO和NO反应生成另外两种无毒气体,应生成氮气与二氧化碳,该反应的化学方程式是:2NO+2CO$\frac{\underline{催化剂}}{△}$ N2+2CO2 ,
故答案为:2NO+2CO$\frac{\underline{催化剂}}{△}$ N2+2CO2 .
点评 本题考查无机物推断,物质的颜色与气体密度是推断突破口,注意对元素化合物知识的掌握,难度不大.


科目:高中化学 来源: 题型:解答题
 氢气是清洁能源,也是重要的化工原料.
氢气是清洁能源,也是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和稀硫酸 | B. | Fe和FeCl3溶液 | C. | FeO和稀硫酸 | D. | Fe2O3和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化还原反应的本质是元素化合价的升降 | |
| B. | 氧化反应和还原反应必然同时发生 | |
| C. | 氧化反应是指反应中失去电子,所含元素化合价升高,被氧化 | |
| D. | 还原反应在反应中失去电子,所含元素化合价升高,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、OH-、K+ | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
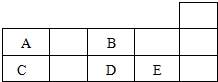
| A. | 对应阴离子的还原性:E>D | B. | 原子半径:C>B | ||
| C. | 对应氧化物的水化物的酸性:E>D | D. | A的非金属性弱于D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com