
下列各组中的离子能大量共存于溶液中的是
A.Na+、K+、HCO3一、OH一 B.Na+、H+、SiO32一、SO42一
C.K+、Cl一、NH4+、OH一 D.Na+、SiO32一、OH一、Cl一
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是( )

A.负极的电极反应式为CO+O2--2e-===CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL 1 mol·L-1的Ca(HCO3)2溶液中,放入2.3 g金属钠充分反应后,有关物质的物理量正确的一组是(NA表示阿伏加德罗常数)( )
| 选项 | 生成CaCO3 | 溶液中HCO | H2 | 转移的电子 |
| A | 0.1 NA | 0.1 NA | ||
| B | 1.12 L | 0.1 NA | ||
| C | 10 g | 0.1 NA | ||
| D | 10 g | 0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程中,没有发生化学变化的是 ( )
A.干冰用于人工降雨
B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C.溶洞中钟乳石的形成
D.工业上合成氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )

| 选项 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
| C | 石蕊溶液先变红后褪色 | Cl2具有漂白性 |
| D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下图中H是无色液体,号称生命之源,B是空气中含量最多的物质,
E是红棕色气体。
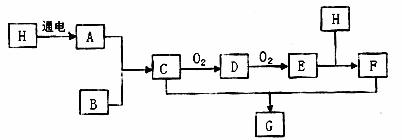
(1)C的化学式是 。
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①D→E 。
②E→D 。
(3)E和H的反应中,氧化剂和还原剂的物质的量比是 。
(4)C和F反应生成G的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:

通过________可以检验流程中滤液2中含有Na+,该实验的具体操作是
。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO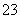 )=0.50 mol/L,c(HCO
)=0.50 mol/L,c(HCO )=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
)=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO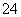 ,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为: ___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com