解:(1)由反应2CO
2+2Na
2O
2=2Na
2CO
3+O
2,2H
2O+2Na
2O
2=4NaOH+O
2↑可知,气体与过氧化钠都按1:1反应,a=1时,混合气体与过氧化钠恰好反应,n(CO
2)=ax=x,固体增重为y=28n(CO
2)+2[1-n(CO
2)]=28x+2(1-x)=26x+2,故答案为:26x+2;
(2)a=2,x=0.5时,n(CO
2)=1mol,二氧化碳与过氧化钠恰好反应,水不反应,从Na
2O
2的真空管出来的气体有氧气、水蒸气,故答案为:氧气、水;
(3)a=2,y=28时,若x≥0.5,水不参加反应,根据过氧化钠计算增重为y=28n(Na
2O
2)=28,故0.5≤x<1,固体增重28g;
若<0.5,二氧化碳完全反应,参加反应的水为[1-n(CO
2)]mol,所以固体增重为y=28n(CO
2)+2[1-n(CO
2)]=28×2x+2(1-2x)=28,解得x=2,不符合题意,
故答案为:0.5≤x<1;
(4)当a=1.25时,若x≥0.8,水不参加反应,根据过氧化钠计算增重为y=28n(Na
2O
2)=28;
若x<0.8,二氧化碳完全反应,参加反应的水为[1-n(CO
2)]mol,所以固体增重为y=28n(CO
2)+2[1-n(CO
2)]=28×2x+2(1-2x)=52x+2,当x=0时中含有氢气,y=2,y与x的关系曲线图为:

,故答案为:
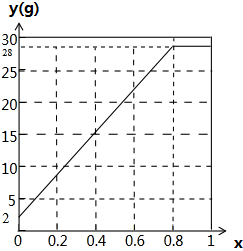
.
分析:一定量的CO
2、H
2O(g)组成的混合气体与过氧化钠反应,可以看做CO
2先与过氧化钠反应,CO
2反应完毕,H
2O(g)再与过氧化钠反应,发生反应2CO
2+2Na
2O
2=2Na
2CO
3+O
2,固体增加的质量相当于与二氧化碳等物质的量的CO的质量,2H
2O+2Na
2O
2=4NaOH+O
2↑,固体增加的质量为相当于与水等物质的量的H
2的质量,根据过氧化钠的物质的量讨论二氧化碳恰好反应时x的值,根据x的值分情况讨论,以此解答.
(1)a=1时,混合气体与过氧化钠恰好反应;
(2)a=2,x=0.5时,n(CO
2)=1mol,二氧化碳与过氧化钠恰好反应,水不反应;
(3)a=2,y=28时,若x≥0.5,水不参加反应,根据过氧化钠计算增重为y=28n(Na
2O
2),若<0.5,二氧化碳完全反应,参加反应的水为[1-n(CO
2)]mol,所以固体增重为y=28n(CO
2)+2[1-n(CO
2)];
(4)当a=1.25时,若x≥0.8,水不参加反应,根据过氧化钠计算增重为y=28n(Na
2O
2),若x<0.8,二氧化碳完全反应,参加反应的水为[1-n(CO
2)]mol,所以固体增重为y=28n(CO
2)+2[1-n(CO
2)];
过氧化钠不足量,采用极限法确定y与x的关系曲线,当气体全部为氢气时,计算y的质量,当气体全部为二氧化碳时,计算y的质量.
点评:本题考查混合物的计算,难度中等,将反应设计为CO
2先与过氧化钠反应,CO
2反应完毕,H
2O(g)再与过氧化钠反应是解题的关键,再判断二氧化碳恰好反应计算x的值,进行讨论.

 ,故答案为:
,故答案为: .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
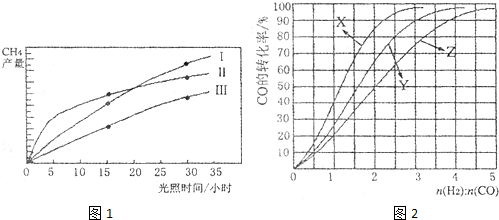
小学生10分钟应用题系列答案 (2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.
(2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.