
| A. | KCl、Br2 | B. | NaCl、KCl | C. | KI、NaCl | D. | NaCl、KCl、I2 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 不用铁片,改用铁粉 | D. | 加少量浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是 、
、 、
、 任意2种(写出任意2种的结构简式)
任意2种(写出任意2种的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
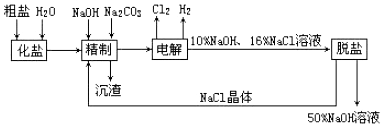
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
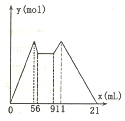 如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质
如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质| A. | 原混合液中,c(A13+):c(Mg2+):c(C1)=1:1:5 | |
| B. | 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B | |
| C. | 若A是NaOH,B是盐酸,则c(NaOH):c(HC1)=2:1 | |
| D. | 从6到9,相应离子反应方程式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
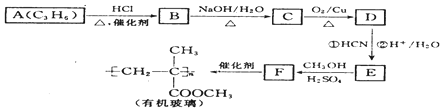
 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$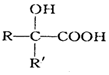 (注:R′可以是H原子)
(注:R′可以是H原子) 是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线
是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线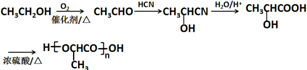 .合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
.合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com