
| A、某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH,pH的大小顺序是:④>③>①>② |
| C、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D、25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1:1 |
| 10-14 |
| 10-10 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
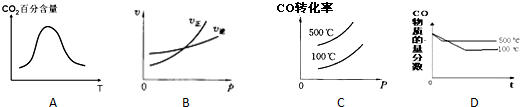
查看答案和解析>>
科目:高中化学 来源: 题型:
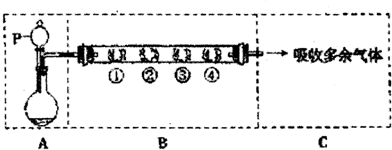
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所 蘸 试剂 | 石蕊试纸 | 品红溶液 | 淀粉和碘水混合物 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色固体 | ||
| 体现SO2性质 | 水溶液显酸性 | 漂白性 | 氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
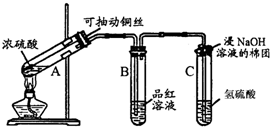
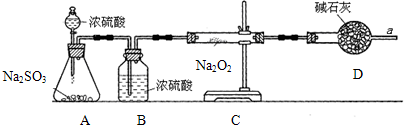
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,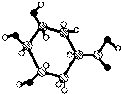 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
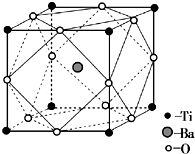 钛被誉为“未来世纪的金属”.试回答下列问题:
钛被誉为“未来世纪的金属”.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g | B、3.36g |
| C、5.60g | D、6.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com