
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐为硫氢酸钠和碳酸氢,反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS;
(2)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2计算;
(3)根据方程式计算平衡常数,然后利用三段式法解答.
解答 解:(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐为硫氢酸钠和碳酸氢,反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS,
故答案为:Na2CO3+H2S═NaHCO3+NaHS;
(2)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1,
一定条件下的密闭容器中,该总反应达到平衡,反应是放热反应,反应前后气体体积减小的反应,要提高CO的转化率,平衡正向进行,
a、压缩体积,压强增大平衡正向进行,一氧化碳转化率增大,故a符合;
b、加入催化剂,改变反应速率不改变化学平衡,转化率不变,故b不符合;
c、减少CO2的浓度,减少生成物浓度平衡正向进行,一氧化碳转化率增大,故c符合;
d、增加CO的浓度,提高氢气转化率,一氧化碳转化率减小,故d不符合;
e、分离出二甲醚(CH3OCH3),平衡正向进行,一氧化碳转化率增大,故e符合;
故答案为:-246.4kJ•mol-1;a、c、e;
(3)①Q=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,反应为放热反应,升高温度,平衡逆向进行,平衡常数K减小,故答案为:减小.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算、化学平衡的影响因素的相关知识,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H两种核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半径:r(Cl)>r(Cl-) | |
| C. | 工业上常用干燥的钢瓶储存液氯,是因为铁和氯气在任何条件下都不反应 | |
| D. | 该反应表明常温下氯气有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①、②均为氧化还原反应 | |
| B. | 反应①中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 上述尾气N0x的吸收过程中.共转移电子的物质的量为1mol | |
| D. | 上述尾气中NO2与N0的体积比为6:1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
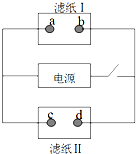 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
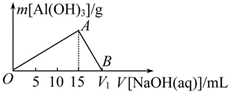 向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com