
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ�����ж���ȷ���ǣ��� ����
��i�� I2��g��+H2��g��![]() 2HI��g����H=��9.48kJ/mol
2HI��g����H=��9.48kJ/mol
��ii�� I2��S��+H2��g��![]() 2HI��g����H=+26.48kJ��
2HI��g����H=+26.48kJ��
A. 1 mol I2��g����ͨ��2gH2��g������Ӧ����9.48 kJ
B. 1 mol��̬����1 mol��̬���������������17.00 kJ
C. ��Ӧ��i���IJ���ȷ�Ӧ��ii���IJ����ȶ�
D. ��Ӧ��ii���ķ�Ӧ���������ȷ�Ӧ��i���ķ�Ӧ����������
���𰸡�B
��������
��֪����I2��g��+H2��g��2HI��g����H=��9.48kJmol��1����I2��s��+H2��g��2HI��g����H=+26.48kJmol��1�����ø�˹���ɽ��٩����ɵ�I2��g��=I2��s����H=��9.48kJmol��1��26.48kJmol��1=��35.96kJmol��1��
A��n��I2��=1moL��n��H2��=1mol�����ڸ÷�ӦΪ���淴Ӧ����ų�������С��9.48kJ����A����
B����I2��g��=I2��s����H=��35.96kJmol��1����֪1mol��̬����1mol��̬���������������35.96kJ����B����
C����Ӧ�������IJ��ﶼ��HI��״̬��ͬ���ȶ�����ͬ����C����
D����I2��g��=I2��s����H=��35.96kJmol��1����֪I2��g����������I2��s������D��ȷ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ݻ�����������У�����N2��3H2 ![]() 2NH3�ķ�Ӧ����ͨ��4 mol H2��4 mol N2��10 s����H2��ʾ�ķ�Ӧ����Ϊ0.12 mol/(L��s)����10 s��������N2�����ʵ�����
2NH3�ķ�Ӧ����ͨ��4 mol H2��4 mol N2��10 s����H2��ʾ�ķ�Ӧ����Ϊ0.12 mol/(L��s)����10 s��������N2�����ʵ�����
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ����ǻ�ѧ�ϳ��еij������ʣ����Ȼ�������������ˮ�⣬�ڸ������ܱ����������������������ܱ�H2O2����ΪCr(��)�������Ȼ�������������:

��1���ظ���立ֽ����������������(Cr2O3������ˮ)��������ˮϴ�ӵ�ԭ��__________��
��2����֪CCl4�е�Ϊ76.8�棬Ϊ��֤�ȶ���CCl4���������˵ļ��ȷ�ʽ��___________��
��3������ͼװ���Ʊ�CrCl3ʱ����Ҫ�������:
�ٽ������ռ����������У�
�ڼ��ȷ�Ӧ����400�棬��ʼ��������ƿ��ͨ�뵪�����������µ�650�棻
��������ƿ��װ��150mL CCl4��������CCl4���¶ȿ�����50��60��֮�䣻
�ܷ�Ӧ�ܳ��ڶ˳�����CrCl3������ʱ���жϼ��ȹ�ʽ¯�ĵ�Դ��
��ֹͣ����CCl4������ͨ�뵪����
���װ�������ԡ�
��ȷ��˳��Ϊ:__________________________��

��4������ͼװ���Ʊ�CrCl3ʱ����������ƿ��ͨ��N2������Ϊ_______________________________
��5���Ʊ�CrC13ʱ���ɵ�����COCl2(�׳ƹ���)�ж���COCl2��ˮ����ˮ�⣬��Ӧ����ʽΪCOCl2+H2O�TCO2��+CHCl��Ϊ�˷�ֹ��Ⱦ��������NaOH��Һ�����չ������仯ѧ����ʽΪ____________________________________________________________��
��6����ϸ��������װ�ã�Ϊ����ȡ���ռ���������CrCl3��������һ������֮��������ΪӦ�øĽ���һ���ʩ��__________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Dz��ֿ�����Դ�����ü���Ʒ����(��ͼ)���й�˵����ƽȷ����
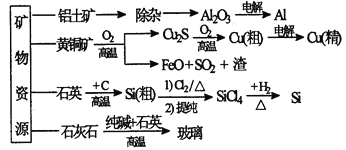
A. ��ͭ��⾫��ʱ����ͭ������
B. ��������ͭ���ߴ��輰���������ж��漰������ԭ��Ӧ
C. ��ͭ��ұͭʱ��������SO2�������������ᣬFeO������ұ����ԭ��
D. �ֹ��Ƹߴ���ʱ���ᴿ���Ȼ�����ö�η���ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T������.������������������ȡ�
![]()
��ش��������⣺
(1)W�����ڱ��е�λ����____________________________________��Q��R��T����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ____________________________________________________________________��(��Ԫ�ط��ű�ʾ)��QO2�ĵ���ʽΪ________________________��R�����������Ļ�ѧʽ____________________________��
(2)T������NaOH ��Һ��Ӧ�����ӷ���ʽΪ____________________________________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�ܱ������д�������ƽ�⣺CO(g)��H2O(g) ![]() CO2(g)��H2(g)��CO2��ƽ�����ʵ���Ũ��c(CO2)���¶�t�Ĺ�ϵ��ͼ��ʾ������˵��������� (����)
CO2(g)��H2(g)��CO2��ƽ�����ʵ���Ũ��c(CO2)���¶�t�Ĺ�ϵ��ͼ��ʾ������˵��������� (����)

A. ƽ��״̬A��C��ȣ�ƽ��״̬A��c(CO)��С
B. ��t2ʱ��D��ķ�Ӧ���ʣ�v(��)��v(��)
C. ��ӦCO(g)��H2O(g) ![]() CO2(g)��H2(g)�Ħ�H��0
CO2(g)��H2(g)�Ħ�H��0
D. ��t1��t2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M���ճ������в���ȱ�ٵĵ�ζƷ����֪C����D��ȼ�շ�����ɫ���档M���������ʼ��ת����ϵ����ͼ��ʾ�����ֲ�������ȥ��

��1����A�ǵ؉��к������Ľ���Ԫ�أ���A���Ȼ�����Һ������������Һ�������ϣ��õ��ij�������AԪ������Һ��AԪ�ص�������ȣ���A�ĸ��Ȼ�����Һ������������Һ�����ʵ���Ũ��֮�ȿ���Ϊ____________��
��2����A��CO2���壬A��B��Һ��Ӧ�����õ���Һ�������ᷴӦ���ų���������ʵ����������������֮��Ĺ�ϵ��ͼ��ʾ:��A��B��Һ��Ӧ����Һ�е�����Ϊ___________���ѧʽ�������ʵ���֮��Ϊ_______��

��3����A��һ�����Σ�A�ֱܷ���B��F��Һ��Ӧ������ɫ�Ҿ��д̼�����ζ�����壬��A�Ļ�ѧʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦN2+3H2 ![]() 2NH3������˵�����ڻ�ѧƽ��״̬����(����)
2NH3������˵�����ڻ�ѧƽ��״̬����(����)
����(N2)��=��(N2)����
��N2��H2��NH3�ķ�����֮��Ϊ1��3��2��
�۵�λʱ��������2molNH3��ͬʱ����1molN2��
��N2��H2��NH3�����ʵ������ٷ����仯��
A. �٢�B. �ڢ�C. �ڢۢ�D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г�����һ�ּ�øϴ�·ۣ�������ϴ�·��м��������ļ��뵰��ø�Ƴɵġ�����ø�Ĵ����Ժ�ǿ������ĺ��ա�Ѫ���������ŷŵĵ����ʣ�����������������ˮ�����ȥ�����������У������ü�øϴ�·�ϴ�ӵ��ǣ�
����Ʒ ��ë֯Ʒ ������֯Ʒ ��˿֯Ʒ
A.�ڢ�B.�ڢ�C.�٢�D.�٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com