
| A. | 10mL | B. | 5mL | C. | 15mL | D. | 0 |
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 主要学习实验方法,体验一下实验操作即可,不必追求精确 | |
| B. | 应该先做好实验报告,并事先填好,再做实验 | |
| C. | 要实事求是地记录自己的测定结果 | |
| D. | 本组实验失误,实验报告可以参照邻组的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
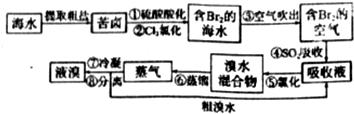
科目:高中化学 来源: 题型:解答题
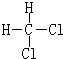 或
或 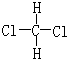
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )
如图为元紊周期表中短周期非金属元素,W原子最外层电子数是其电子层数的2倍,下列说法不正确的是( )| A. | 原子半径Y>Z | B. | WZ2能使酸性高锰酸钾溶液褪色 | ||
| C. | X的氢化物比Y的氢化物稳定 | D. | W元素氧化物的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{28}$ | B. | m | C. | $\frac{m}{14}$ | D. | 28m |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .氟元素最低负化合价为-1 价.
.氟元素最低负化合价为-1 价. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH- | B. | Na+、H+、OH-、Cl- | ||
| C. | NH4+、Mg2+、SO42-、Cl- | D. | Na+、Cl-、AlO2-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com