
【题目】在氯化铵溶液中,下列关系式正确的是( )
A.c(Cl﹣)>c(NH ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.c(NH ![]() )>c(Cl﹣)>c(H+)>c(OH﹣)
)>c(Cl﹣)>c(H+)>c(OH﹣)
C.c(Cl﹣)=c(NH ![]() )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
D.c(NH ![]() )=c(Cl﹣)>c(H+)>c(OH﹣)
)=c(Cl﹣)>c(H+)>c(OH﹣)
【答案】A
【解析】解:A、NH4Cl中铵根离子水解可得[Cl﹣]>[NH ![]() ],铵根离子水解溶液显酸性,则[H+]>[OH﹣],离子水解的程度很弱,则[NH
],铵根离子水解溶液显酸性,则[H+]>[OH﹣],离子水解的程度很弱,则[NH ![]() ]>[H+],即[Cl﹣]>[NH
]>[H+],即[Cl﹣]>[NH ![]() ]>[H+]>[OH﹣],故A正确; B、因NH4Cl中铵根离子水解可得[Cl﹣]>[NH
]>[H+]>[OH﹣],故A正确; B、因NH4Cl中铵根离子水解可得[Cl﹣]>[NH ![]() ],故B错误;
],故B错误;
C、因NH4Cl中铵根离子水解可得[Cl﹣]>[NH ![]() ],铵根离子水解溶液显酸性,则[H+]>[OH﹣],故C错误;
],铵根离子水解溶液显酸性,则[H+]>[OH﹣],故C错误;
D、由NH4Cl中铵根离子水解可得[Cl﹣]>[NH ![]() ],故D错误;
],故D错误;
故选A.
由氯化铵的化学式为NH4Cl,Cl﹣与NH ![]() 的物质的量之比为1:1,根据氯化铵溶液中铵根离子水解可知,[Cl﹣]>[NH
的物质的量之比为1:1,根据氯化铵溶液中铵根离子水解可知,[Cl﹣]>[NH ![]() ],铵根离子水解溶液显酸性,则[H+]>[OH﹣],然后分析选项即可.
],铵根离子水解溶液显酸性,则[H+]>[OH﹣],然后分析选项即可.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氯化钠钠晶体不导电是没有离子存在
B. 氯水能导电,但是氯气既不是电解质也不是非电解质
C. KNO3在电流作用下在水中电离出K+和NO3-
D. 用萃取、分液的方法分离汽油和煤油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式: Zn(s)+ ![]() O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
Hg(l)+ ![]() O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为( )
A.﹣260.4 kJmol﹣1
B.﹣441.8 kJmol﹣1
C.+260.4 kJmol﹣1
D.+441.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2(已知SiO2不溶于水,也不与强酸和强碱反应)等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题:

(1)写出沉淀物的化学式:a______; f______。
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式:________________、______________。
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式:___________________、_______________。
(4)铁有许多重要的化合物,中学化学常见的有三种氧化物和两种氢氧化物,则 Fe(OH)2 转化成Fe(OH)3的现象为___________________________。同时铁元素还有许多盐,FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2![]() O72-)进行处理。在酸性条件下Cr2
O72-)进行处理。在酸性条件下Cr2![]() O72-被还原为Cr3+,写出在酸性条件下FeSO4·7H2O与Cr2
O72-被还原为Cr3+,写出在酸性条件下FeSO4·7H2O与Cr2![]() O72-反应的离子方程式:_______________________________________________________________________________
O72-反应的离子方程式:_______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国成为全球首个实现海域成功开采可燃冰的国家,可燃冰是一种甲烷的水合物,下列有关甲烷的说法正确的是
A. 分子式为CH4 B. 极易溶于水 C. 常温下不稳定 D. 是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图. 请回答以下问题: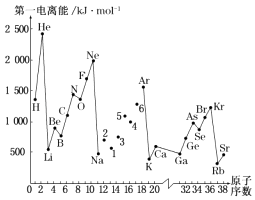
(1)从图分析可知,同一主族元素原子的第一电离能I1的变化规律是 .
(2)图中5号元素在周期表中的位置是、 .
(3)图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是: .
(4)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519kJmol﹣1 , 失去第二个电子为7296kJmol﹣1 , 失去第三个电子为11 799kJmol﹣1 , 由此数据分析为何锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不符合“绿色化学”这一主题的是( )
A. 推广和鼓励多使用公共交通工具出行
B. 秸秆就地焚烧,降低运输成本
C. 大力发展太阳能和风力发电
D. 对燃煤进行脱硫,减少SO2对空气的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。

(1)装置B中盛放____溶液,C和F中装的是同一种试剂,该试剂为________________。
(2)装置A的圆底烧瓶中发生反应的化学方程式为_______________________________。
(3)实验步骤:如图连接装置后,先检验装置气密性,再装药品,然后点燃___________(填“A”或“C”)处酒精灯,当____(填实验现象)时,再点燃___________(填“A”或“C”)处酒精灯。
(4)装置G的作用是__________________,写出G中反应的离子方程式_____________________。
(5)甲同学认为装置D和E中间的细玻璃导管换成粗的玻璃导管为什么?___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com