
| A. | 所涉及元素的第一电离能:N>O>C | |
| B. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| C. | 等物质的量N2和C02中,π键的个数比为1:1 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
分析 A.N元素最外层p轨道为半充满结构,第一电离能较大;
B.x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍;
C.根据结构式N≡N、O=C=O判断;
D.根据电子转移守恒计算NOx中N元素的化合价.
解答 解:A.同周期元素从左到右元素的第一电离能逐渐增大,但N元素最外层p轨道为半充满结构,第一电离能大于相邻元素,则为N>O>C,故A正确;
B.x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍,每生成1mol N2,转移电子数为1mol×2×4=8mol,故B错误;
C.由结构式N≡N、O=C=O可知等物质的量N2和C02中,π键的个数比为2:2=1:1,故C正确;
D.令NOx中N元素的化合价为a,由氧化剂与还原剂的物质的量之比为1:1,则1×(a-0)=1×(4-2),解得a=2,故D正确.
故选B.
点评 本题考查化学键、氧化还原反应原理及其计算等,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,注意理解氧化还原反应中电子转移守恒.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 硅酸钠溶液 | C. | NaOH溶液 | D. | NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
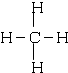 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com